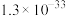1 . 我国科学家屠呦呦因青蒿素研究获得诺贝尔奖,某实验小组拟提取青蒿素并进行测定。
【查阅资料】青蒿素为无色针状晶体,熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水中几乎不溶。
Ⅰ.实验室用乙醚提取青蒿素的工艺流程如下图:___________ ,在操作Ⅰ前要对青蒿进行粉碎,其目的是___________ 。
(2)操作Ⅱ的名称是___________ 。
(3)操作Ⅲ进行的是重结晶,其操作步骤为:加热溶解→___________ →___________ →过滤、洗涤、干燥。
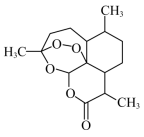
Ⅱ.青蒿素分子结构如下图所示,它也可用有机溶剂A从中药中提取。___________ ;从青蒿素的结构可以判断,青蒿素___________ (填易溶、不易溶)于水。
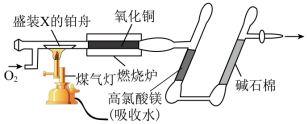
借助李比希法确定有机溶剂A的实验式 (最简式)。利用如图所示的装置测定有机化合物A的组成,取4.4gA与足量氧气充分燃烧,实验结束后,高氯酸镁的质量增加3.6g,碱石棉的质量增加8.8g。___________ 。
②根据图2,推测A可能所属有机化合物的类别___________ ,分子式为___________ 。
③根据以上结果和图3 (三组峰的面积比为3:3:2),推测A的结构简式为___________ 。
【查阅资料】青蒿素为无色针状晶体,熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水中几乎不溶。
Ⅰ.实验室用乙醚提取青蒿素的工艺流程如下图:

(2)操作Ⅱ的名称是
(3)操作Ⅲ进行的是重结晶,其操作步骤为:加热溶解→
Ⅱ.青蒿素分子结构如下图所示,它也可用有机溶剂A从中药中提取。
借助李比希法确定有机溶剂A的实验式 (最简式)。利用如图所示的装置测定有机化合物A的组成,取4.4gA与足量氧气充分燃烧,实验结束后,高氯酸镁的质量增加3.6g,碱石棉的质量增加8.8g。
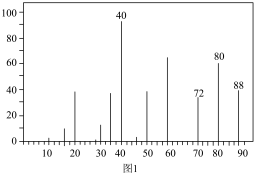


②根据图2,推测A可能所属有机化合物的类别
③根据以上结果和图3 (三组峰的面积比为3:3:2),推测A的结构简式为
您最近半年使用:0次
名校
解题方法
2 . 我国科学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖。青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为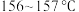 ,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为
,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为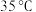 ,与水不互溶,从黄花蒿中提取青蒿素的方法是乙醚漫取法,主要工艺流程为:
,与水不互溶,从黄花蒿中提取青蒿素的方法是乙醚漫取法,主要工艺流程为:
(1)先对黄花蒿进行干燥破碎后加入乙醚的目的是_______ 。
(2)操作II先经过_______ 操作,既可以回收乙醚,又可以使提取液浓缩、结晶,再经过滤可得到青蒿素粗品。操作III的主要过程可能包括_______ (填序号)。
 加水溶解,蒸发浓缩、冷却结晶
加水溶解,蒸发浓缩、冷却结晶
 加
加 的乙醇,浓缩、结晶、过滤
的乙醇,浓缩、结晶、过滤
 加入乙醚进行萃取分液
加入乙醚进行萃取分液
(3)用如图实验装置测定青蒿素实验式的方法如下:将一定质量的青蒿素样品放在硬质玻璃管 中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置
中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置 和
和 实验前后的质量,根据所测数据计算。
实验前后的质量,根据所测数据计算。_______ ,装置 的作用是
的作用是_______ 。
②某同学认为上述装置存在不足之处,请你指出该问题并提出改进的措施:_______ 。
③装置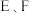 中盛放的物质是分别是
中盛放的物质是分别是_______ 。
a.碱石灰、无水氯化钙 b.无水氯化钙、碱石灰 c.浓硫酸、碱石灰
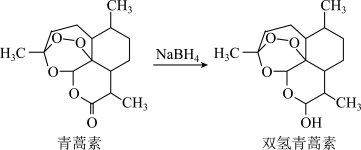
(4)科学家在青蒿素的研究中进一步发现,一定条件下可把青蒿素转化为双氢青蒿素。_______ 。
 通过元素分析与质谱法可确定其分子式
通过元素分析与质谱法可确定其分子式
 青蒿素分子中含有过氧键、酯基和醚键
青蒿素分子中含有过氧键、酯基和醚键
 青蒿素是芳香族化合物
青蒿素是芳香族化合物
 古有“青蒿一握,以水二升溃,绞取汁”,利用的是固-液萃取原理
古有“青蒿一握,以水二升溃,绞取汁”,利用的是固-液萃取原理
②双氢青蒿素比青蒿素水溶性更好,因而疗效更好。从结构与性质关系角度推测主要原因是_______ 。
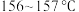 ,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为
,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为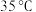 ,与水不互溶,从黄花蒿中提取青蒿素的方法是乙醚漫取法,主要工艺流程为:
,与水不互溶,从黄花蒿中提取青蒿素的方法是乙醚漫取法,主要工艺流程为:
(1)先对黄花蒿进行干燥破碎后加入乙醚的目的是
(2)操作II先经过
 加水溶解,蒸发浓缩、冷却结晶
加水溶解,蒸发浓缩、冷却结晶 加
加 的乙醇,浓缩、结晶、过滤
的乙醇,浓缩、结晶、过滤 加入乙醚进行萃取分液
加入乙醚进行萃取分液(3)用如图实验装置测定青蒿素实验式的方法如下:将一定质量的青蒿素样品放在硬质玻璃管
 中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置
中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置 和
和 实验前后的质量,根据所测数据计算。
实验前后的质量,根据所测数据计算。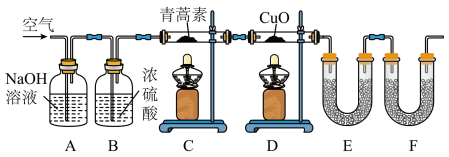
 的作用是
的作用是②某同学认为上述装置存在不足之处,请你指出该问题并提出改进的措施:
③装置
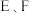 中盛放的物质是分别是
中盛放的物质是分别是a.碱石灰、无水氯化钙 b.无水氯化钙、碱石灰 c.浓硫酸、碱石灰
(4)科学家在青蒿素的研究中进一步发现,一定条件下可把青蒿素转化为双氢青蒿素。
 通过元素分析与质谱法可确定其分子式
通过元素分析与质谱法可确定其分子式 青蒿素分子中含有过氧键、酯基和醚键
青蒿素分子中含有过氧键、酯基和醚键 青蒿素是芳香族化合物
青蒿素是芳香族化合物 古有“青蒿一握,以水二升溃,绞取汁”,利用的是固-液萃取原理
古有“青蒿一握,以水二升溃,绞取汁”,利用的是固-液萃取原理②双氢青蒿素比青蒿素水溶性更好,因而疗效更好。从结构与性质关系角度推测主要原因是
您最近半年使用:0次
3 . 五氯化锑 主要用作氟化工的催化剂,纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应
主要用作氟化工的催化剂,纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应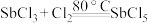 ,利用如下装置制备
,利用如下装置制备 (加热及夹持装置略)。
(加热及夹持装置略)。 的部分性质如下:
的部分性质如下:
实验室制备 的步骤如下:
的步骤如下:
(i)连接好仪器,检验装置气密性,加入药品;
(ii)……,控制三颈烧瓶反应温度在 ,通入
,通入 至反应结束,通入
至反应结束,通入 排净装置中
排净装置中 ;
;
(iii)在b处连接减压装置,……,打开减压装置,三颈烧瓶中液体流入双颈烧瓶,……,减压蒸馏,收集目标物质。
(1)步骤(ii)反应温度控制在 的主要目的是
的主要目的是_______ 。
(2)步骤(iii)打开减压装置前的操作是_______ ,用减压蒸馏而不用常压蒸馏的主要原因是_______ 。
(3)减压蒸馏时若控制压强为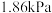 ,温度计的读数应为
,温度计的读数应为_______ ℃,减压蒸馏时玻璃毛细管的作用是_______ 。
(4)该实验装置存在一处明显的设计缺陷,该缺陷是_______ 。
(5)氟锑酸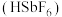 是一种超强酸,可由
是一种超强酸,可由 与
与 反应制得,反应的化学方程式是
反应制得,反应的化学方程式是_______ ,制备时,应选用_______ 材质的仪器(填标号)。
A.玻璃 B.陶瓷 C.铁或铝 D.聚四氟乙烯
 主要用作氟化工的催化剂,纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应
主要用作氟化工的催化剂,纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应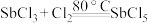 ,利用如下装置制备
,利用如下装置制备 (加热及夹持装置略)。
(加热及夹持装置略)。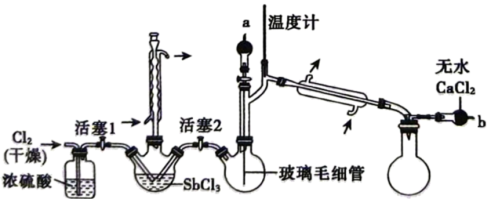
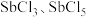 的部分性质如下:
的部分性质如下:| 物质 | 熔点/℃ | 沸点/℃ | 性质 |
 | 73.4 |  | 均极易水解 |
 | 2.8 |  | |
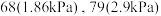 |
 的步骤如下:
的步骤如下:(i)连接好仪器,检验装置气密性,加入药品;
(ii)……,控制三颈烧瓶反应温度在
 ,通入
,通入 至反应结束,通入
至反应结束,通入 排净装置中
排净装置中 ;
;(iii)在b处连接减压装置,……,打开减压装置,三颈烧瓶中液体流入双颈烧瓶,……,减压蒸馏,收集目标物质。
(1)步骤(ii)反应温度控制在
 的主要目的是
的主要目的是(2)步骤(iii)打开减压装置前的操作是
(3)减压蒸馏时若控制压强为
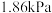 ,温度计的读数应为
,温度计的读数应为(4)该实验装置存在一处明显的设计缺陷,该缺陷是
(5)氟锑酸
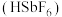 是一种超强酸,可由
是一种超强酸,可由 与
与 反应制得,反应的化学方程式是
反应制得,反应的化学方程式是A.玻璃 B.陶瓷 C.铁或铝 D.聚四氟乙烯
您最近半年使用:0次
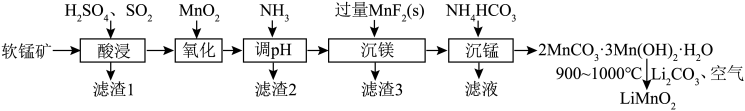
4 . 层状LiMnO2在电动车、空间技术等范畴具有十分广阔的应用前景。LiMnO2可由软锰矿(主要成分是MnO2,含少量Fe2O3、Al2O3、SiO2、MgO等)制备,其制备流程如图:
回答下列问题:
(1) LiMnO2中锰元素的化合价为______ ;“酸浸”后过滤,所得滤液中主要含有的金属阳离子有______ 。
(2)为了提高“酸浸”的浸取速率,可采取的措施有______ (写出两点)。
(3)“氧化”步骤需要加入过量MnO2,该步反应的离子方程式为______ 。
(4)常温下,“调pH”后溶液pH=5,则滤渣2的主要成分是______ 。
(5)滤渣3与浓H2SO4反应可以释放HF,同时得到的副产物是______ 。
(6)测定 LiMnO2样品中锰含量:取10g LiMnO2样品,粉碎后加入浓盐酸、30%H2O2溶液,充分反应,生成Mn(Ⅱ)。加入蒸馏水标定溶液体积为250mL,移取25mL后加入KB指示剂,用0.15mol/L的EDTA标准溶液滴定,平均消耗60mL标准溶液。样品中锰含量为______ %(已知:EDTA与Mn2+反应的化学计量数之比为1∶1)。
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1) LiMnO2中锰元素的化合价为
(2)为了提高“酸浸”的浸取速率,可采取的措施有
(3)“氧化”步骤需要加入过量MnO2,该步反应的离子方程式为
(4)常温下,“调pH”后溶液pH=5,则滤渣2的主要成分是
(5)滤渣3与浓H2SO4反应可以释放HF,同时得到的副产物是
(6)测定 LiMnO2样品中锰含量:取10g LiMnO2样品,粉碎后加入浓盐酸、30%H2O2溶液,充分反应,生成Mn(Ⅱ)。加入蒸馏水标定溶液体积为250mL,移取25mL后加入KB指示剂,用0.15mol/L的EDTA标准溶液滴定,平均消耗60mL标准溶液。样品中锰含量为
您最近半年使用:0次
解题方法
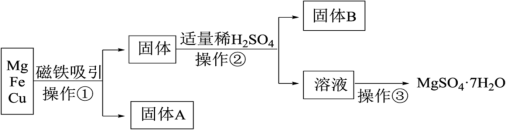
5 . 有Mg、Fe、Cu的混合粉末,分离得到MgSO4·7H2O过程如下:___________ 。
(2)操作②的名称是___________ ,需要用到的主要玻璃仪器有 ___________ 、玻璃棒,其中玻璃棒的作用是___________ 。
(3)操作②发生的离子反应方程式为___________ ,属于___________ 反应。(填基本反应类型)
(4)实验中可选用适量的下列试剂中的代替稀H2SO4___________ (填标号)。
A. CuSO4溶液 B.FeSO4溶液 C.稀盐酸
(5)操作③主要包含蒸发浓缩、___________ 、过滤、洗涤烘干等。
(2)操作②的名称是
(3)操作②发生的离子反应方程式为
(4)实验中可选用适量的下列试剂中的代替稀H2SO4
A. CuSO4溶液 B.FeSO4溶液 C.稀盐酸
(5)操作③主要包含蒸发浓缩、
您最近半年使用:0次
解题方法
6 . 粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。某班同学在粗盐提纯实验中,为把少量可溶性杂质 、
、 一并除去,设计了如下方案:
一并除去,设计了如下方案:
(1)为了加快粗盐的溶解,可采取的措施有_______ (填一种即可)。
(2)写出步骤ⅳ中发生反应的化学方程式:_______ 。
(3)沉淀B的主要成分为_______ (填化学式);往沉淀B中加入足量稀盐酸,观察到的现象为_______ 。
(4)在步骤ⅵ中,___ (填“能”或“不能”)用稀硝酸代替稀盐酸进行该实验,理由为____ 。
(5)步骤ⅶ中操作b指的是_______ 。
(6)该方案实际得到的氯化钠比粗盐中含有的氯化钠要多,理由为_______ 。
 、
、 一并除去,设计了如下方案:
一并除去,设计了如下方案: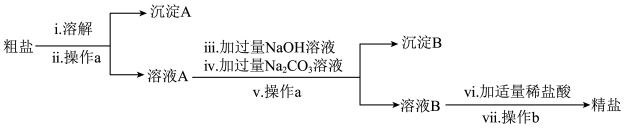
(1)为了加快粗盐的溶解,可采取的措施有
(2)写出步骤ⅳ中发生反应的化学方程式:
(3)沉淀B的主要成分为
(4)在步骤ⅵ中,
(5)步骤ⅶ中操作b指的是
(6)该方案实际得到的氯化钠比粗盐中含有的氯化钠要多,理由为
您最近半年使用:0次
解题方法
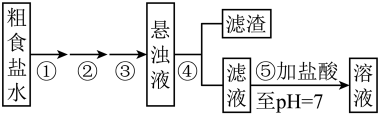
7 . 实验活动探究---食盐的精制
实验目的:从粗食盐水中除去
实验用品:
试剂:粗食盐水,稀盐酸,稀硫酸, 溶液,
溶液, 溶液,
溶液, 溶液,
溶液, 溶液
溶液
仪器:烧杯,漏斗,玻璃棒,表面皿, 试纸,滤纸,试管,胶头滴管,铁架台(带铁圈)
试纸,滤纸,试管,胶头滴管,铁架台(带铁圈)
实验操作流程: 离子,需加入过量的
离子,需加入过量的_______ ,写出①中反应的离子方程式_______ 。
(2)操作②加入过量的____ ,写出②中反应的离子方程式___ ;操作③加入过量的 溶液,除了除去
溶液,除了除去 ,还要除去操作①引入的杂质离子
,还要除去操作①引入的杂质离子______ 。
(3)操作④为_______ ,其中玻璃棒的作用是_______ 。
(4)操作⑤向滤液中滴加盐酸,用玻璃棒搅拌,直到_______ ,并用 试纸检验,使滤液呈中性或微酸性。
试纸检验,使滤液呈中性或微酸性。
(5)操作流程④与⑤可以颠倒顺序吗?_______ ,为什么?_______ 。
实验目的:从粗食盐水中除去

实验用品:
试剂:粗食盐水,稀盐酸,稀硫酸,
 溶液,
溶液, 溶液,
溶液, 溶液,
溶液, 溶液
溶液仪器:烧杯,漏斗,玻璃棒,表面皿,
 试纸,滤纸,试管,胶头滴管,铁架台(带铁圈)
试纸,滤纸,试管,胶头滴管,铁架台(带铁圈)实验操作流程:
 离子,需加入过量的
离子,需加入过量的(2)操作②加入过量的
 溶液,除了除去
溶液,除了除去 ,还要除去操作①引入的杂质离子
,还要除去操作①引入的杂质离子(3)操作④为
(4)操作⑤向滤液中滴加盐酸,用玻璃棒搅拌,直到
 试纸检验,使滤液呈中性或微酸性。
试纸检验,使滤液呈中性或微酸性。(5)操作流程④与⑤可以颠倒顺序吗?
您最近半年使用:0次
8 . 回答下列问题:
(1)某化学社团为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。
已知:溶液的导电性由溶液中离子的浓度及离子电荷数决定,可通过观察实验现象,判断溶液中离子浓度的变化,从而证明反应是离子反应。实验装置如图所示:
(2)写出下列情况发生反应的离子方程式:向NaHSO4液中逐滴加入Ba(OH)2溶液至溶液显中性___________ 。
(3)某化工厂排出的废水呈酸性,且其中含大量的Na+、Cu2+、Cl-、 ,为除去废水样品中的Cu2+和
,为除去废水样品中的Cu2+和 ,最终得到中性溶液,设计的方案流程如下图:
,最终得到中性溶液,设计的方案流程如下图:___________ (用离子符号表示)。
②上述流程中,试剂c为___________ (写化学式)。
(1)某化学社团为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。
已知:溶液的导电性由溶液中离子的浓度及离子电荷数决定,可通过观察实验现象,判断溶液中离子浓度的变化,从而证明反应是离子反应。实验装置如图所示:
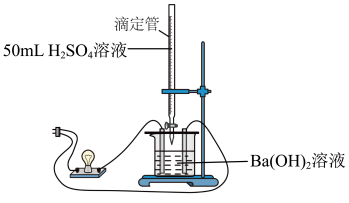
| 实验步骤 | 实验现象 | 实验结论 |
| 连接好装置,向烧杯中加入一定浓度的Ba(OH)2溶液,逐滴滴加H2SO4溶液直至过量,边滴边振荡 | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(2)写出下列情况发生反应的离子方程式:向NaHSO4液中逐滴加入Ba(OH)2溶液至溶液显中性
(3)某化工厂排出的废水呈酸性,且其中含大量的Na+、Cu2+、Cl-、
 ,为除去废水样品中的Cu2+和
,为除去废水样品中的Cu2+和 ,最终得到中性溶液,设计的方案流程如下图:
,最终得到中性溶液,设计的方案流程如下图: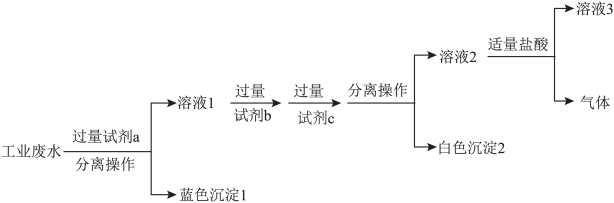
②上述流程中,试剂c为
您最近半年使用:0次
解题方法
9 . 氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2,并回收过量的SOCl2。回答下列问题:
②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2 CuCl2+2SO2↑+4HCl↑。
CuCl2+2SO2↑+4HCl↑。
(1)仪器a的名称是_______ ,锥形瓶中得到的物质X的化学式为_______ 。
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是_______
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(滴定反应为I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
①滴定到终点时溶液中的颜色变化是_______
②该试样中铜元素的百分含量为_______ 。
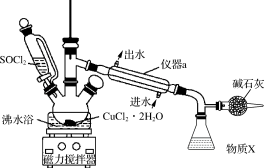
②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2
 CuCl2+2SO2↑+4HCl↑。
CuCl2+2SO2↑+4HCl↑。(1)仪器a的名称是
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(滴定反应为I2+2S2O
 =S4O
=S4O +2I-)。
+2I-)。①滴定到终点时溶液中的颜色变化是
②该试样中铜元素的百分含量为
您最近半年使用:0次
解题方法
10 . 回答下列问题:
(1)海水制得的粗盐中常常含有泥沙、Ca2+ 、Mg2+ 、SO 等杂质,粗盐提纯的步骤有:①加入过量的 Na2CO3溶液;②加入过量的 NaOH 溶液;③加入过量的 BaCl2溶液;④用适量盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是
等杂质,粗盐提纯的步骤有:①加入过量的 Na2CO3溶液;②加入过量的 NaOH 溶液;③加入过量的 BaCl2溶液;④用适量盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是___________ 。(填选项字母)。
a.⑤⑥③②①⑥④⑦ b.⑤⑥①③②⑥④⑦ c.⑤⑥③①②④⑥⑦ d.⑤⑥②③①⑥④⑦
(2)粗盐提纯实验中用到的盐酸的物质的量浓度为 0.500mol L-1,现实验室某浓盐酸试剂瓶上的有关数据如下:欲用上述浓盐酸配制实验所需浓度的稀盐酸 480mL。
L-1,现实验室某浓盐酸试剂瓶上的有关数据如下:欲用上述浓盐酸配制实验所需浓度的稀盐酸 480mL。
①需量取的浓盐酸的体积为:___________ mL。
②下列操作的正确顺序是___________ (用字母表示)。
B→___________ → ___________→ ___________→ ___________→G
A.上下颠倒摇匀;B.量取;C.洗涤;D.定容;E.稀释;F.移液;G.装瓶
③下列操作会使所配溶液浓度偏低的是___________ 。(填标号)
a.配制前,容量瓶中有少量蒸馏水
b.量取盐酸读数时,仰视刻度线
c.量取盐酸后,洗涤量筒倒入烧杯中
d.定容时水不慎超过了刻度线,用滴管吸出
e.向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
(3)配制 500g 0.9%的生理盐水,下列仪器不需要用到的有___________ 。(填仪器名称)
(1)海水制得的粗盐中常常含有泥沙、Ca2+ 、Mg2+ 、SO
 等杂质,粗盐提纯的步骤有:①加入过量的 Na2CO3溶液;②加入过量的 NaOH 溶液;③加入过量的 BaCl2溶液;④用适量盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是
等杂质,粗盐提纯的步骤有:①加入过量的 Na2CO3溶液;②加入过量的 NaOH 溶液;③加入过量的 BaCl2溶液;④用适量盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是a.⑤⑥③②①⑥④⑦ b.⑤⑥①③②⑥④⑦ c.⑤⑥③①②④⑥⑦ d.⑤⑥②③①⑥④⑦
(2)粗盐提纯实验中用到的盐酸的物质的量浓度为 0.500mol
 L-1,现实验室某浓盐酸试剂瓶上的有关数据如下:欲用上述浓盐酸配制实验所需浓度的稀盐酸 480mL。
L-1,现实验室某浓盐酸试剂瓶上的有关数据如下:欲用上述浓盐酸配制实验所需浓度的稀盐酸 480mL。| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19 g/cm3 HCl质量分数/:36.5% |
②下列操作的正确顺序是
B→___________ → ___________→ ___________→ ___________→G
A.上下颠倒摇匀;B.量取;C.洗涤;D.定容;E.稀释;F.移液;G.装瓶
③下列操作会使所配溶液浓度偏低的是
a.配制前,容量瓶中有少量蒸馏水
b.量取盐酸读数时,仰视刻度线
c.量取盐酸后,洗涤量筒倒入烧杯中
d.定容时水不慎超过了刻度线,用滴管吸出
e.向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
(3)配制 500g 0.9%的生理盐水,下列仪器不需要用到的有
a.  b.
b.  c.
c.  d.
d. 
您最近半年使用:0次