名校
1 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。查阅资料显示:
a. 在一定条件下能被
在一定条件下能被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
b.浓碱条件下, 可被
可被 还原为
还原为 。
。
c. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
d. 为白色沉淀。实验装置如下图:
为白色沉淀。实验装置如下图:
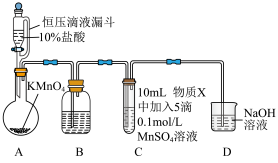
(1)A中发生的反应的化学方程式如下: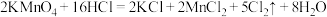 。用双线桥标出该反应中电子转移的方向、得失和数目
。用双线桥标出该反应中电子转移的方向、得失和数目___________ 。
(2)通入 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为___________ 。
(3)对比实验Ⅰ、Ⅱ通入 后的实验现象,对于
后的实验现象,对于 还原性与溶液酸碱性的认识是
还原性与溶液酸碱性的认识是___________ 。
(4)根据资料b,Ⅲ中应得到绿色溶液,而实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用离子方程式表示可能导致溶液碱性减弱的原因:___________ 。
②取Ⅲ中放置后的 悬浊液,加入
悬浊液,加入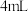 40%
40% 溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为___________ 。同时还可观察到溶液的绿色缓慢加深,即可证明Ⅲ的悬浊液中氧化剂过量。
a.
 在一定条件下能被
在一定条件下能被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。b.浓碱条件下,
 可被
可被 还原为
还原为 。
。c.
 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。d.
 为白色沉淀。实验装置如下图:
为白色沉淀。实验装置如下图:
| 序号 | 物质X | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5% 溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40% 溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)A中发生的反应的化学方程式如下:
 。用双线桥标出该反应中电子转移的方向、得失和数目
。用双线桥标出该反应中电子转移的方向、得失和数目(2)通入
 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为(3)对比实验Ⅰ、Ⅱ通入
 后的实验现象,对于
后的实验现象,对于 还原性与溶液酸碱性的认识是
还原性与溶液酸碱性的认识是(4)根据资料b,Ⅲ中应得到绿色溶液,而实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的
 悬浊液,加入
悬浊液,加入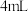 40%
40% 溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
您最近一年使用:0次
2023-12-11更新
|
58次组卷
|
2卷引用:福建省厦门大学附属科技中学2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
2 . 如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持仪器已略)。已知:卤素单质的氧化性:Cl2> Br2> I2,如:Cl2+ 2NaBr = Br2+ 2NaCl。
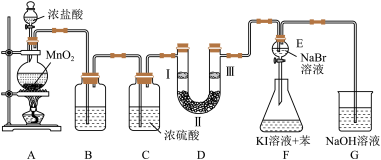
(1)装置B中饱和食盐水的作用是_____ 。
(2)装置D的作用是验证氯气是否具有漂白性,为此D中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是_____ (填字母编号)。
(3)设计装置F的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开E中活塞,将装置E中少量溶液加入装置F中,振荡,观察到的现象是_____ ,该现象______ (填“能”或“不能”)说明溴单质的氧化性强于碘单质,原因是_____ 。
(4)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4+ 16HCl(浓)=2KCl + 2MnCl2+ 5Cl2↑ + 8H2O
①在化学方程式上用双线桥法标出该反应中电子转移的方向和数目_____ 。
②在该反应中,浓盐酸表现出来的性质是_____ (填氧化性、还原性、酸性或碱性等)。
③上述反应中,有126. 4 g的KMnO4参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙的质量为_____ g;制得的漂白粉应密封保存,原因是_____ 。(用化学方程式表示)

(1)装置B中饱和食盐水的作用是
(2)装置D的作用是验证氯气是否具有漂白性,为此D中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水氯化钙 | 湿润的有色布条 |
| c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4+ 16HCl(浓)=2KCl + 2MnCl2+ 5Cl2↑ + 8H2O
①在化学方程式上用双线桥法标出该反应中电子转移的方向和数目
②在该反应中,浓盐酸表现出来的性质是
③上述反应中,有126. 4 g的KMnO4参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙的质量为
您最近一年使用:0次
名校
解题方法
3 . 某校实验小组欲探究 溶液与
溶液与 的反应。
的反应。
Ⅰ.配制 溶液。
溶液。
(1)由 固体配制
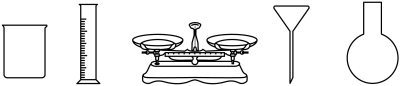
固体配制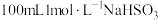 溶液,下列仪器中需要使用的有
溶液,下列仪器中需要使用的有_______ (写出名称)。
Ⅱ.探究 溶液与
溶液与 的反应。
的反应。
经查阅资料,该实验小组设计了如下实验,结合实验现象回答下列问题:
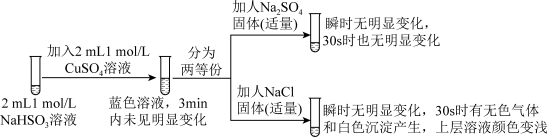
已知: 易溶于水;CuCl为白色难溶于水的固体。
易溶于水;CuCl为白色难溶于水的固体。
(2)若试管d中发生了氧化还原反应,写出该反应的离子方程式_______ 。
(3)该实验小组对试管d中加入NaCl固体后产生白色沉淀的原因提出了如下猜想:
猜想1: 改变了
改变了 的还原性。
的还原性。
猜想2: 改变了
改变了 的氧化性。
的氧化性。
为进一步证实上述猜想,该实验小组利用原电池原理设计了如下实验:
通过分析上表中对比实验现象可知_______ (填“猜想1”或“猜想2”)不合理。
(4)为证明猜想2的合理性,对实验1的装置做了如下改进:
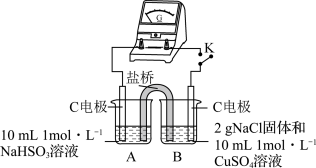
①烧杯B中的石墨电极是原电池的_______ 极,电极反应式为_______ 。
②闭合开关K,若_______ (描述实验现象),说明猜想2合理。
③请从化学反应原理的角度解释原因_______ ,使 与
与 的反应能够进行完全。
的反应能够进行完全。
 溶液与
溶液与 的反应。
的反应。Ⅰ.配制
 溶液。
溶液。(1)由
 固体配制
固体配制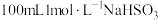 溶液,下列仪器中需要使用的有
溶液,下列仪器中需要使用的有
Ⅱ.探究
 溶液与
溶液与 的反应。
的反应。经查阅资料,该实验小组设计了如下实验,结合实验现象回答下列问题:

已知:
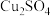 易溶于水;CuCl为白色难溶于水的固体。
易溶于水;CuCl为白色难溶于水的固体。(2)若试管d中发生了氧化还原反应,写出该反应的离子方程式
(3)该实验小组对试管d中加入NaCl固体后产生白色沉淀的原因提出了如下猜想:
猜想1:
 改变了
改变了 的还原性。
的还原性。猜想2:
 改变了
改变了 的氧化性。
的氧化性。为进一步证实上述猜想,该实验小组利用原电池原理设计了如下实验:
| 编号 | 实验1 | 实验2 |
| 实验装置 | 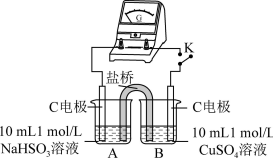 | 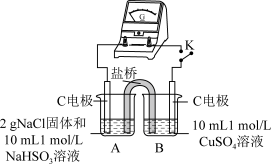 |
| 实验现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
(4)为证明猜想2的合理性,对实验1的装置做了如下改进:

①烧杯B中的石墨电极是原电池的
②闭合开关K,若
③请从化学反应原理的角度解释原因
 与
与 的反应能够进行完全。
的反应能够进行完全。
您最近一年使用:0次
2023-02-07更新
|
521次组卷
|
3卷引用:福建省漳州市2023届高三毕业班1月教学质量检测化学试题
福建省漳州市2023届高三毕业班1月教学质量检测化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(实验综合题)湖南省永州市第一中学2022-2023学年高三下学期3月月考化学试题
20-21高一下·浙江·阶段练习
4 . 在氮的化合物中,有一类盐叫亚硝酸盐,如亚硝酸钠(NaNO2)等。它们广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂;它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生过被误当食盐食用的事件。某同学查阅有关资料,了解到亚硝酸及亚硝酸盐的资料相一关信息:(1)HNO2是一种弱酸(比醋酸略强),且不稳定,易分解生成NO和NO2。(2)NO 既有氧化性又有还原性,能被常见的强氧化剂氧化,在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。(3)AgNO2是一种难溶于水、易溶于硝酸的化合物。下列有关说法不正确的是
既有氧化性又有还原性,能被常见的强氧化剂氧化,在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。(3)AgNO2是一种难溶于水、易溶于硝酸的化合物。下列有关说法不正确的是
 既有氧化性又有还原性,能被常见的强氧化剂氧化,在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。(3)AgNO2是一种难溶于水、易溶于硝酸的化合物。下列有关说法不正确的是
既有氧化性又有还原性,能被常见的强氧化剂氧化,在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。(3)AgNO2是一种难溶于水、易溶于硝酸的化合物。下列有关说法不正确的是| A.可用AgNO3和HNO3两种试剂来鉴别NaNO2和NaCl |
B.亚硝酸钠可以使酸性KMnO4溶液褪色,发生反应的离子方程式可表示为:5NO +2 +2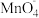 +6H+=5NO +6H+=5NO +2Mn2++3H2O +2Mn2++3H2O |
| C.在冷冻的亚硝酸钠溶液中加入稀硫酸、通入CO2或SO2均能制得HNO2 |
| D.若误食亚硝酸盐(如NaNO2),会导致血红蛋白中Fe2+被转化为Fe3+而中毒,可服用维生素C解毒,这个过程体现了维生素C的还原性 |
您最近一年使用:0次
5 . Ⅰ.已知 与Zn可以发生如下反应:
与Zn可以发生如下反应: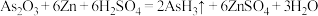 (
( 中As化合价为-3)。
中As化合价为-3)。
(1)请用单线桥法标出电子转移的方向和数目______ 。
(2) 在上述反应中显示出来的性质是______(填序号)。
在上述反应中显示出来的性质是______(填序号)。
Ⅱ.完成下列问题
(3)在 、
、 、
、 、
、 ,S、
,S、 、
、 中,只有氧化性的是
中,只有氧化性的是______ ,只有还原性的是______ ,既有氧化性又有还原性的是____________ 。
(4)下列三个氧化还原反应中,氧化性最强的物质是______ 。
①
②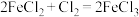
③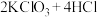 (浓)
(浓)
若溶质中 与
与 共存,为了氧化
共存,为了氧化 而
而 不被氧化,除单质外,还应用上述反应中的
不被氧化,除单质外,还应用上述反应中的______ 作氧化剂。
 与Zn可以发生如下反应:
与Zn可以发生如下反应: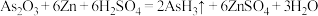 (
( 中As化合价为-3)。
中As化合价为-3)。(1)请用单线桥法标出电子转移的方向和数目
(2)
 在上述反应中显示出来的性质是______(填序号)。
在上述反应中显示出来的性质是______(填序号)。| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
Ⅱ.完成下列问题
(3)在
 、
、 、
、 、
、 ,S、
,S、 、
、 中,只有氧化性的是
中,只有氧化性的是(4)下列三个氧化还原反应中,氧化性最强的物质是
①

②
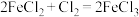
③
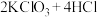 (浓)
(浓)
若溶质中
 与
与 共存,为了氧化
共存,为了氧化 而
而 不被氧化,除单质外,还应用上述反应中的
不被氧化,除单质外,还应用上述反应中的
您最近一年使用:0次
名校
6 . 回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为: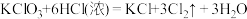 。
。
(1)请用“双线桥”表示上述反应电子转移的方向和数目___________ 。
(2)反应中,氧化剂为___________ ,氧化产物为:___________ 。
(3)浓盐酸在反应中体现出来的性质有___________ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为 ,该反应中还原剂是
,该反应中还原剂是___________ 。(填化学式)
(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。
②每生成1个 转移
转移___________ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:
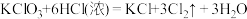 。
。(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)反应中,氧化剂为
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为
 ,该反应中还原剂是
,该反应中还原剂是(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个
 转移
转移
您最近一年使用:0次
解题方法
7 . 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目____________ 。该反应中氧化产物是_____________ (填化学式);若有2molHI被氧化,则被还原的氧化剂粒子数是________________ 。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是_____ (填序号)
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是_________________ (填序号)
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_________________________________________________ 。
| 药品 | NaNO2(亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐 |
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式
您最近一年使用:0次
名校
解题方法
8 . 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目:___ 。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+ 而中毒,可服用维生素C 解毒。下列分析错误的是__ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是___ (填序号)。
A.焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___ 。
| 药品 | NaNO2 (亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目:
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+ 而中毒,可服用维生素C 解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是
A.焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
您最近一年使用:0次
解题方法
9 . 回答下列问题
(1)下列物质中:A. NaCl晶体;B. SO2气体;C.H2SO4溶液;D. CH3CH2OH(酒精)溶液;E. 单质铜;F.熔融氯化钾;G.液态氯化氢
① 能够直接导电的是_______ ;
②虽溶于水能导电,但不属于电解质的是_______ ;
③ 虽不能直接导电,但属于电解质的是_______ 。
(2)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下: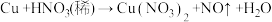 (未配平)
(未配平)
①被还原的元素是_______ 。
②请用单线桥法标出电子转移的方向和数目_______ 。
③HNO3在上述反应中显示出来的性质有_______ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(1)下列物质中:A. NaCl晶体;B. SO2气体;C.H2SO4溶液;D. CH3CH2OH(酒精)溶液;E. 单质铜;F.熔融氯化钾;G.液态氯化氢
① 能够直接导电的是
②虽溶于水能导电,但不属于电解质的是
③ 虽不能直接导电,但属于电解质的是
(2)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
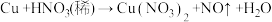 (未配平)
(未配平)①被还原的元素是
②请用单线桥法标出电子转移的方向和数目
③HNO3在上述反应中显示出来的性质有
A.氧化性 B.还原性 C.酸性 D.碱性
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题:
(1)亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。
①已知亚硝酸钠能发生如下反应,请将化学方程式配平:____ 。
______NaNO2+______HI=______NO↑+______NaI+______I2+______H2O
②用单线桥法标出该反应中电子转移的方向及数目:____ 。
③被氧化的原子与被还原的原子数目之比为____ 。
④HI在反应中表现的性质是____ (填“氧化性”、“还原性”和“酸性”)。
(2)自来水中的NO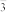 对人类健康会产生危害,碱性条件下用Mg还原NO
对人类健康会产生危害,碱性条件下用Mg还原NO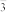 ,主要产物是Mg(OH)2、N2等,写出该反应过程的离子方程式
,主要产物是Mg(OH)2、N2等,写出该反应过程的离子方程式____ 。
(1)亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。
①已知亚硝酸钠能发生如下反应,请将化学方程式配平:
______NaNO2+______HI=______NO↑+______NaI+______I2+______H2O
②用单线桥法标出该反应中电子转移的方向及数目:
③被氧化的原子与被还原的原子数目之比为
④HI在反应中表现的性质是
(2)自来水中的NO
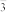 对人类健康会产生危害,碱性条件下用Mg还原NO
对人类健康会产生危害,碱性条件下用Mg还原NO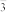 ,主要产物是Mg(OH)2、N2等,写出该反应过程的离子方程式
,主要产物是Mg(OH)2、N2等,写出该反应过程的离子方程式
您最近一年使用:0次



