解题方法
1 . A、B、C、D是中学化学常见的三种物质,它们之间的相互转化关系如下(反应条件及部分产物已略去):_______ 、_______ 、_______ 。
(2)若A是空气中体积分数最大的气体,C是红棕色气体,则反应①②③的化学方程式分别为_______ 、_______ 、_______ 。
(3)①②③三步反应中,一定属于氧化还原反应的是_______ (填序号)。
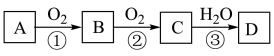
(2)若A是空气中体积分数最大的气体,C是红棕色气体,则反应①②③的化学方程式分别为
(3)①②③三步反应中,一定属于氧化还原反应的是
您最近一年使用:0次
2 . I.元素的价类二维图是我们学习元素及其化合物相关知识的重要模型工具,也是发展证据推理与模型认知这一科学核心素养的重要途径。如图为氯元素的价类二维图,回答下列问题:_________ ;Cl2O极易溶于水,与水反应生成Z,写出对应的化学方程式为________ 。
(2)根据化合价判断氧化性
_____  (填“>”、“<”或“=”);已知反应:
(填“>”、“<”或“=”);已知反应: ,则
,则
______ (填“是”或“不是”)酸性氧化物。
(3)已知实验室制备 的方式之一为
的方式之一为 ,请参考下列示例,用双线桥法标注电子转移的方向、数目,元素化合价变化情况与发生反应类型:
,请参考下列示例,用双线桥法标注电子转移的方向、数目,元素化合价变化情况与发生反应类型:_____________ 。 消毒液中滴加白醋增强漂白性的离子方程式为:
消毒液中滴加白醋增强漂白性的离子方程式为:______________ 。
Ⅱ.大多数的化学反应都是在溶剂中进行的,配制溶液是进行化学实验操作的基本技能。已知某“84消毒液”瓶体部分标签如图所示。根据信息回答下列问题:
(5)某实验需配制 的
的 消毒液,现用该“84”消毒液配制,需要用量筒量取该“84”消毒液的体积为
消毒液,现用该“84”消毒液配制,需要用量筒量取该“84”消毒液的体积为_____ mL。在配制过程中,除需要量筒、烧杯、玻璃棒外还必需的玻璃仪器有_________ 。
(6)下列操作可能使配制溶液浓度偏低的是___________(填字母)。

(2)根据化合价判断氧化性

 (填“>”、“<”或“=”);已知反应:
(填“>”、“<”或“=”);已知反应: ,则
,则
(3)已知实验室制备
 的方式之一为
的方式之一为 ,请参考下列示例,用双线桥法标注电子转移的方向、数目,元素化合价变化情况与发生反应类型:
,请参考下列示例,用双线桥法标注电子转移的方向、数目,元素化合价变化情况与发生反应类型:
 消毒液中滴加白醋增强漂白性的离子方程式为:
消毒液中滴加白醋增强漂白性的离子方程式为:Ⅱ.大多数的化学反应都是在溶剂中进行的,配制溶液是进行化学实验操作的基本技能。已知某“84消毒液”瓶体部分标签如图所示。根据信息回答下列问题:
| 商品名称:84消毒液 【有效成分】  【  摩尔质量】 摩尔质量】 【规格】  【质量分数】7.45% 【密度】约为  |
(5)某实验需配制
 的
的 消毒液,现用该“84”消毒液配制,需要用量筒量取该“84”消毒液的体积为
消毒液,现用该“84”消毒液配制,需要用量筒量取该“84”消毒液的体积为(6)下列操作可能使配制溶液浓度偏低的是___________(填字母)。
| A.容量瓶用蒸馏水洗净后,没烘干就直接使用 | B.移液时,未洗涤烧杯内壁和玻璃棒 |
| C.定容摇匀后,发现液面低于刻度线,又加水至刻度线 | D.定容时,俯视刻度线 |
您最近一年使用:0次
名校
解题方法
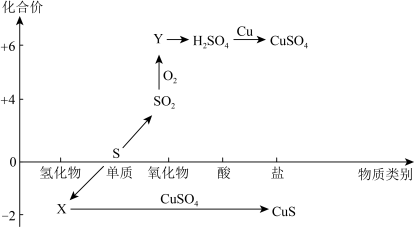
3 . 硫及其化合物的“价-类”二维图如下图所示,回答下列问题:___________ ,Y的化学式是___________ 。
(2)检验 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入___________ ,无明显现象,再加入___________ 溶液,若产生白色沉淀,则溶液中含有 。
。
(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓) CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。
①请用“双线桥”法标明该反应电子转移的方向和数目___________ 。
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为___________ L。
(2)检验
 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入 。
。(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓)
 CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。①请用“双线桥”法标明该反应电子转移的方向和数目
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为
您最近一年使用:0次
名校
解题方法
4 . 以柠檬酸、硫酸亚铁、氨水等为原料制备食品添加剂—柠檬酸铁铵[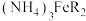 ,M=488g·mol-1]的流程如下所示:
,M=488g·mol-1]的流程如下所示:_______ 。
(2)欲检验FeSO4溶液是否被完全氧化,选用的试剂为_______。
(3)上述流程中,以13.90g绿矾(FeSO4·7H2O)配制FeSO4溶液,经各步骤后,最终制取得19.52g柠檬酸铁铵,则柠檬酸铁铵的产率为_______ 。
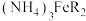 ,M=488g·mol-1]的流程如下所示:
,M=488g·mol-1]的流程如下所示: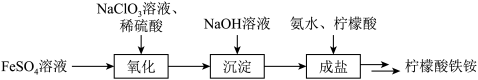
(2)欲检验FeSO4溶液是否被完全氧化,选用的试剂为_______。
| A.NaOH溶液 | B.KSCN溶液 | C.酸性KMnO4溶液 | D.新制氯水 |
(3)上述流程中,以13.90g绿矾(FeSO4·7H2O)配制FeSO4溶液,经各步骤后,最终制取得19.52g柠檬酸铁铵,则柠檬酸铁铵的产率为
您最近一年使用:0次
解题方法
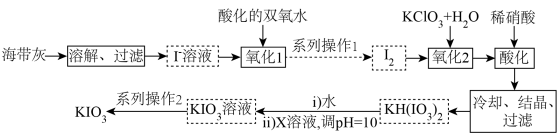
5 . 1833年,布森戈提出用富含碘的盐治疗甲肿,这是第一位提出向盐中添加碘防治甲肿的人。我国政府规定:碘盐添加KIO3。某厂生产碘酸钾(KIO3)的工艺流程如图所示。
(1) KIO3属于__________ (填“酸”“碱”“盐”或“氧化物”),其中I的化合价为__________ 价。
(2)“氧化1”中发生反应的离子方程式为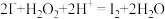 ,用单线桥法标出该反应中电子转移的方向和数目:
,用单线桥法标出该反应中电子转移的方向和数目:______________ ,该氧化过程中需要控制温度不宜过高,其原因是______________ 。系列操作2包括蒸发浓缩_______________ 过滤、乙醇洗涤、干燥等。
(3)X的化学式为______________ 。
(4)测定产品纯度:称取wg产品溶于蒸馏水,滴加适量稀硫酸,加入VmLcmol/LKI溶液恰好完全反应,发生反应: (未配平)。
(未配平)。
①根据上述数据,测得产品中碘元素质量分数为__________ (用含w、c、V的表达式表示)。
②如果将稀硫酸换成稀硝酸,则测得结果会__________ (填“偏高”“偏低”或“无影响”)。
(1) KIO3属于
(2)“氧化1”中发生反应的离子方程式为
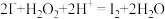 ,用单线桥法标出该反应中电子转移的方向和数目:
,用单线桥法标出该反应中电子转移的方向和数目:(3)X的化学式为
(4)测定产品纯度:称取wg产品溶于蒸馏水,滴加适量稀硫酸,加入VmLcmol/LKI溶液恰好完全反应,发生反应:
 (未配平)。
(未配平)。①根据上述数据,测得产品中碘元素质量分数为
②如果将稀硫酸换成稀硝酸,则测得结果会
您最近一年使用:0次
名校
解题方法
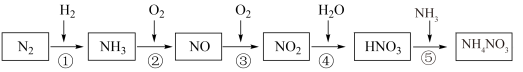
6 . 氮元素及其化合物的转化关系如图所示:___________ ,写出 的电子式
的电子式___________ 。
(2)浓、稀 的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:
的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:___________ 。
(3)氮氧化物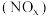 是大气污染物之一,处理
是大气污染物之一,处理 对于环境保护具有重要的意义。在一定条件下
对于环境保护具有重要的意义。在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。 ,反应的化学方程式为
,反应的化学方程式为___________ ;装置B内的试剂是___________ 。
②在装置 中
中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中  和
和 的物质的量之比为
的物质的量之比为___________ 。
③工厂里常采用 溶液吸收
溶液吸收 的混合气体,使其转化为化工产品
的混合气体,使其转化为化工产品 ,试写出其化学方程式:
,试写出其化学方程式:___________ 。
④用不同浓度的 溶液吸收
溶液吸收 含量不同的尾气,关系如图:(
含量不同的尾气,关系如图:( 表示尾气里
表示尾气里 中
中 的含量)
的含量) 含量越大,氮氧化物的吸收率越大,当
含量越大,氮氧化物的吸收率越大,当 小于
小于 时,加入
时,加入  能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是___________ 。
(4) 是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:___________ (写出操作步骤、现象和结论)。
 的电子式
的电子式(2)浓、稀
 的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:
的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:(3)氮氧化物
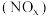 是大气污染物之一,处理
是大气污染物之一,处理 对于环境保护具有重要的意义。在一定条件下
对于环境保护具有重要的意义。在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。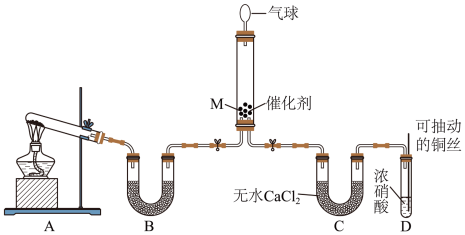
 ,反应的化学方程式为
,反应的化学方程式为②在装置
 中
中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中  和
和 的物质的量之比为
的物质的量之比为③工厂里常采用
 溶液吸收
溶液吸收 的混合气体,使其转化为化工产品
的混合气体,使其转化为化工产品 ,试写出其化学方程式:
,试写出其化学方程式:④用不同浓度的
 溶液吸收
溶液吸收 含量不同的尾气,关系如图:(
含量不同的尾气,关系如图:( 表示尾气里
表示尾气里 中
中 的含量)
的含量)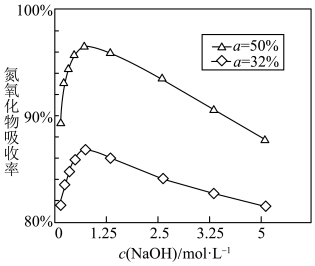
 含量越大,氮氧化物的吸收率越大,当
含量越大,氮氧化物的吸收率越大,当 小于
小于 时,加入
时,加入  能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是(4)
 是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
您最近一年使用:0次
7 . 海洋是资源的宝库,以海水为原料可以制取粗盐、Br2、镁等多种物质。
I.粗盐中主要含NaCl,还含有少量泥沙、CaCl2、MgCl2和Na2SO4。
(1)将粗盐提纯的方法是:将粗盐溶于水,向里面依次加入稍过量的_______ (填字母),过滤,将滤液用盐酸酸化后,蒸发结晶。
A.Na2CO3 B.NaOH C.BaCl2
(2)实验中,判断所加BaCl2溶液已经过量的方法是_______ 。
II.浓缩海水中含有NaCl、NaBr等物质。从浓缩海水中提取溴的流程如下:_______ 。
(4)“吸收”时是用SO2水溶液吸收空气吹出的溴蒸汽。写出“吸收”时发生反应的化学方程式,并用双线桥标出电子转移的方向和数目:_______ 。
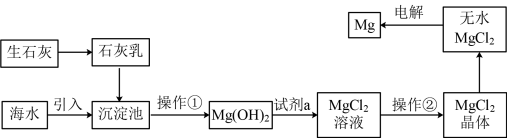
III.从海水中提取镁流程如下:
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(5)操作②是_______ 、过滤。
(6)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质,而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制取金属镁,其原因是_______ 。
I.粗盐中主要含NaCl,还含有少量泥沙、CaCl2、MgCl2和Na2SO4。
(1)将粗盐提纯的方法是:将粗盐溶于水,向里面依次加入稍过量的
A.Na2CO3 B.NaOH C.BaCl2
(2)实验中,判断所加BaCl2溶液已经过量的方法是
II.浓缩海水中含有NaCl、NaBr等物质。从浓缩海水中提取溴的流程如下:

(4)“吸收”时是用SO2水溶液吸收空气吹出的溴蒸汽。写出“吸收”时发生反应的化学方程式,并用双线桥标出电子转移的方向和数目:
III.从海水中提取镁流程如下:
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(5)操作②是
(6)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质,而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制取金属镁,其原因是
您最近一年使用:0次
解题方法
8 . 现有A、B、C、D四种物质,它们分别是 (稀)、
(稀)、 四种物质中的一种,它们之间的反应关系及所发生反应的反应类型如图所示,请回答:物质A为
四种物质中的一种,它们之间的反应关系及所发生反应的反应类型如图所示,请回答:物质A为_______ ,B为_______ ,C为_______ ,D为_______ ,其中属于氧化还原反应的是_______ (用化学方程式表示)。
 (稀)、
(稀)、 四种物质中的一种,它们之间的反应关系及所发生反应的反应类型如图所示,请回答:物质A为
四种物质中的一种,它们之间的反应关系及所发生反应的反应类型如图所示,请回答:物质A为
您最近一年使用:0次
解题方法
9 . I.高铁酸盐是一种新型、高效、多功能绿色水处理剂,工业上可用湿法制备高铁酸钾:2Fe(OH)3+3ClO-+4OH-=2FeO +3Cl-+5H2O。
+3Cl-+5H2O。
(1)FeO 中铁元素的化合价为
中铁元素的化合价为___________ ,在该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)请用单线桥表示反应中电子转移情况:___________ 。
(3)在下列反应中,水既不作氧化剂又不作还原剂是___________(填序号)。
II.为了庆祝元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。下表是元素周期表的一部分,数字①~⑦代表前四周期七种主族元素。请按题目要求回答下列问题:___________ (填元素符号);它在周期表中的位置为___________ 。
(5)上述元素对应的单质中,既能与酸反应又能与碱反应的是___________ (填化学式),写出该单质与氢氧化钠反应的离子方程式___________ 。
 +3Cl-+5H2O。
+3Cl-+5H2O。(1)FeO
 中铁元素的化合价为
中铁元素的化合价为(2)请用单线桥表示反应中电子转移情况:
(3)在下列反应中,水既不作氧化剂又不作还原剂是___________(填序号)。
A.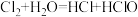 | B. |
C. | D. |
II.为了庆祝元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。下表是元素周期表的一部分,数字①~⑦代表前四周期七种主族元素。请按题目要求回答下列问题:

(5)上述元素对应的单质中,既能与酸反应又能与碱反应的是
您最近一年使用:0次
10 . 氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)人体正常的血红蛋白中含有 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而使人体中毒,服用维生素C可解毒。
而使人体中毒,服用维生素C可解毒。 转化为
转化为 时,
时, 在反应中被
在反应中被______ (填“氧化”或“还原”);服用维生素C可使血红蛋白中的 转变成
转变成 ,说明维生素C作
,说明维生素C作______ (填“氧化”或“还原”)剂。
(2)治理汽车尾气的一种方法是在汽车的排气管上装一个催化转换装置,使 和
和 反应,生成
反应,生成 和
和 。写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目
。写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目______
(3)某届奥运会期间,由于工作人员将84消毒液(有效成分 )与双潮水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是
)与双潮水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
______  (填“>”或“<”);当参加反应的,
(填“>”或“<”);当参加反应的, 和
和 分子的个数比为1:1时,该反应的还原产物为
分子的个数比为1:1时,该反应的还原产物为______ (填字母序号)。
A. B.
B. C.
C. D.
D. E.
E. F.
F.
(4)过氧化钙( )是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取
)是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取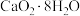 ,再经脱水制得
,再经脱水制得 ,
,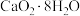 不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水
不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水 ,其制备过程如下:
,其制备过程如下:______
Ⅱ.“沉淀”时发生的反应用化学方程式表示为:______ 。
(1)人体正常的血红蛋白中含有
 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而使人体中毒,服用维生素C可解毒。
而使人体中毒,服用维生素C可解毒。 转化为
转化为 时,
时, 在反应中被
在反应中被 转变成
转变成 ,说明维生素C作
,说明维生素C作(2)治理汽车尾气的一种方法是在汽车的排气管上装一个催化转换装置,使
 和
和 反应,生成
反应,生成 和
和 。写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目
。写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目(3)某届奥运会期间,由于工作人员将84消毒液(有效成分
 )与双潮水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是
)与双潮水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
 (填“>”或“<”);当参加反应的,
(填“>”或“<”);当参加反应的, 和
和 分子的个数比为1:1时,该反应的还原产物为
分子的个数比为1:1时,该反应的还原产物为A.
 B.
B. C.
C. D.
D. E.
E. F.
F.
(4)过氧化钙(
 )是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取
)是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取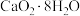 ,再经脱水制得
,再经脱水制得 ,
,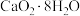 不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水
不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水 ,其制备过程如下:
,其制备过程如下: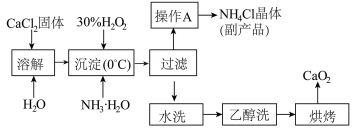
Ⅱ.“沉淀”时发生的反应用化学方程式表示为:
您最近一年使用:0次



