名校
1 . 南高实验学习小组经查阅资料发现:K2FeO4(Mr=198)为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。现将他们制备高铁酸钾(K2FeO4),测定其纯度并探究其性质的过程展示如下。
(1)制备K2FeO4(夹持装置略)
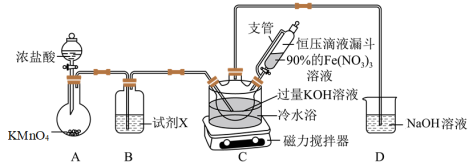
①A为氯气发生装置,盛KMnO4固体的仪器名称是___________ 。
②装置B中所用的试剂X为___________ 。
③装置C中首先制备KClO,然后在快速搅拌下将90%的Fe(NO3)3溶液分批加入装置C中,充分反应得K2FeO4固体,写出该反应的化学方程式___________ 。
(2)K2FeO4的纯度测定
向3mLCrCl3溶液中加入20mL饱和KOH溶液(Cr3++4OH-=CrO +2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO
+2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO
+Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO +2H+=Cr2O
+2H+=Cr2O +H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O
+H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为
+6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为___________ (过程中杂质不参与反应)。
(3)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.方案Ⅰ中溶液变红可知a中含有___________ 离子,但该离子的产生不能判断一定是K2FeO4被Cl-还原得到,还可能由___________ 产生(用离子反应方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-,用KOH溶液洗涤的目的是___________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2___________ FeO (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,盛KMnO4固体的仪器名称是
②装置B中所用的试剂X为
③装置C中首先制备KClO,然后在快速搅拌下将90%的Fe(NO3)3溶液分批加入装置C中,充分反应得K2FeO4固体,写出该反应的化学方程式
(2)K2FeO4的纯度测定
向3mLCrCl3溶液中加入20mL饱和KOH溶液(Cr3++4OH-=CrO
 +2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO
+2H2O),再加入5mL蒸馏水,冷却至室温,准确称取1.98g样品,加入上述溶液中使其溶解,充分反应(FeO +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO
+Fe(OH)3↓+OH-),过滤后加入稀硫酸酸化(2CrO +2H+=Cr2O
+2H+=Cr2O +H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O
+H2O),并加入1mL苯二胺磺酸钠作指示剂,用1.00mol/L的标准硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定(Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为
+6Fe2++14H+=2Cr3++6Fe3++7H2O),至终点时,消耗(NH4)2Fe(SO4)2溶液的体积为27.00mL。则K2FeO4的质量分数为(3)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-,用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2 . 某实验小组用下列装置制备高铁酸钾( K2FeO4 )并探究其性质,制备原理为:3Cl2+2Fe(OH)3+ 10KOH=2K2FeO4+6KCl+8H2O。(夹持装置略)
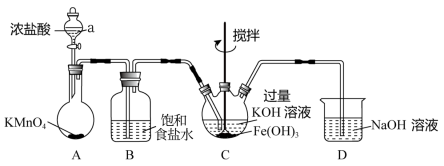
查阅资料:①K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2。②ClO-能将盐酸氧化成氯气。
I. K2FeO4的制备
(1)仪器a的名称为___________ ,D中的NaOH溶液可以用___________ 代替(填入对应字母)。
A.蒸馏水 B.澄清石灰水 C.石灰乳 D.饱和食盐水
(2)检验气体发生装置A气密性的方法是___________ ; 该装置中生成黄绿色气体的化学反应方程式为___________ 。
(3)制备K2FeO4需要在___________ (填“酸性”“碱性”或“中性”)环境中进行,根据上述K2FeO4的制备实验得出:氧化性Cl2___________ FeO (填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式
(填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式___________ 。
II.探究K2FeO4的性质
(4)实验方案:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液。取少量该溶液于试管中,滴加过量盐酸后发现有Cl2产生。
①为确保氧化Cl-的物质只能是FeO ,则用KOH溶液洗涤的目的是
,则用KOH溶液洗涤的目的是___________ 。
②由(4)的实验得出Cl2和FeO 的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是
的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是___________ 。

查阅资料:①K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2。②ClO-能将盐酸氧化成氯气。
I. K2FeO4的制备
(1)仪器a的名称为
A.蒸馏水 B.澄清石灰水 C.石灰乳 D.饱和食盐水
(2)检验气体发生装置A气密性的方法是
(3)制备K2FeO4需要在
 (填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式
(填“>”或“<”)。装置C中Cl2还会与过量的KOH发生反应,请写出其离子反应方程式II.探究K2FeO4的性质
(4)实验方案:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液。取少量该溶液于试管中,滴加过量盐酸后发现有Cl2产生。
①为确保氧化Cl-的物质只能是FeO
 ,则用KOH溶液洗涤的目的是
,则用KOH溶液洗涤的目的是②由(4)的实验得出Cl2和FeO
 的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是
的氧化性强弱关系与I中制备K2FeO4实验时得出的结论相反,其可能的原因是
您最近一年使用:0次
2022-01-15更新
|
330次组卷
|
2卷引用:四川省资阳市2021-2022学年高一上学期期末考试化学试题
3 . I.完成下列氧化还原反应相关问题。
(1)误食NaNO2会使人体血红蛋白中的Fe2+转化为Fe3+而导致中毒,该过程中NaNO2表现出___________ (填“氧化性”或“还原性”)。
(2)已知NaNO2可以与NH4Cl反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
Ⅱ.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物ClO2。其反应的化学方程式为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(3)该反应中的氧化产物为___________ (填化学式)。
(4)浓盐酸在该反应中显示出来的性质是___________ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(5)在碱性条件下加入NaClO3,可将NaCrO2转化为Na2CrO4,ClO 被还原为Cl−,其离子方程式为
被还原为Cl−,其离子方程式为___________ 。还原性:
___________ Cl−(填“>”“<”或“=”)。
(1)误食NaNO2会使人体血红蛋白中的Fe2+转化为Fe3+而导致中毒,该过程中NaNO2表现出
(2)已知NaNO2可以与NH4Cl反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:
Ⅱ.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物ClO2。其反应的化学方程式为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(3)该反应中的氧化产物为
(4)浓盐酸在该反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(5)在碱性条件下加入NaClO3,可将NaCrO2转化为Na2CrO4,ClO
 被还原为Cl−,其离子方程式为
被还原为Cl−,其离子方程式为
您最近一年使用:0次
4 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱:数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如下表所示:(注意:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为___________ (填序号)。
① ②酸性
②酸性 ③酸性
③酸性
(2)已知 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是___________ 。
a. b.
b. c.
c.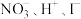 d.
d.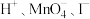
(3)向等浓度的 和FeCl2混合溶液滴加少量酸性
和FeCl2混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为___________ 。
(4)已知常温下 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1: 将淀粉氧化; 猜想2:
将淀粉氧化; 猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。
①实验1所用试剂a为___________ 。
②试剂b是一种可溶性含碘化合物,该反应的离子方程式为___________ 。
结合上述信息思考:对于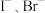 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出合理的氧化方案:加入
,请提出合理的氧化方案:加入___________ 。(合理即给分)
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱:数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如下表所示:(注意:实验中进行酸化时均用稀硫酸)
| 物质 | FeCl3 | KMnO4(酸化) | NaNO3(酸化) | Br2 | I2 | Na2S |
| 浓度 | 0.10M(M为物质的量浓度的单位) | |||||
| 电位值/mV | 171 | 1130 | 603 | 662 | 116 | -361 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
①
 ②酸性
②酸性 ③酸性
③酸性
(2)已知
 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是a.
 b.
b. c.
c.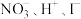 d.
d.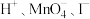
(3)向等浓度的
 和FeCl2混合溶液滴加少量酸性
和FeCl2混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知常温下
 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1: 将淀粉氧化; 猜想2:
将淀粉氧化; 猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。| 序号 | 实验操作 | 试剂 | 观察实验现象 | 结论 |
| 1 | 分别取少量褪色后溶液于三支试管中,并加入对应试剂 | a | 溶液变蓝 | 猜想1不正确 |
| 2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确 | |
| 3 | b+稀H2SO4 | 溶液变蓝 |
②试剂b是一种可溶性含碘化合物,该反应的离子方程式为
结合上述信息思考:对于
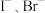 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出合理的氧化方案:加入
,请提出合理的氧化方案:加入
您最近一年使用:0次
名校
解题方法
5 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为_______ (填序号)。
① ②酸性
②酸性 ③酸性
③酸性
(2)已知 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是_______ 。
a. b.
b. c.
c.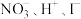 d.
d.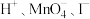
(3)向等浓度的 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为_______ 。
(4)已知常温下 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。
①猜想1为_______ ,实验1所用试剂 为
为_______ 。
②试剂b是一种可溶性含碘化合物,该反应的离子方程式为_______ 。
(5)已知下列四种氧化剂(均可氧化 )对应的还原产物情况如下:
)对应的还原产物情况如下:
请判断,等数量的四种氧化剂微粒分别与足量 作用,得到
作用,得到 最多的是
最多的是_______ 。
(6)结合上述信息思考:对于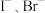 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入_______ ;②加入_______ 。
(7) 具有很强的氧化性(还原产物为
具有很强的氧化性(还原产物为 ),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是
),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是 的
的_______ 倍(保留两位有效数字)。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 |  |  (酸化) (酸化) |  (酸化) (酸化) |  |  |  |
| 浓度 | 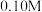 (M为物质的量浓度的单位) (M为物质的量浓度的单位) | |||||
电位值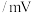 | 171 | 1130 | 603 | 662 | 116 | 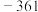 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
①
 ②酸性
②酸性 ③酸性
③酸性
(2)已知
 与
与 不能共存,由此推测下列能大量共存的离子组是
不能共存,由此推测下列能大量共存的离子组是a.
 b.
b. c.
c.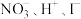 d.
d.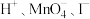
(3)向等浓度的
 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知常温下
 遇淀粉变蓝。现往淀粉
遇淀粉变蓝。现往淀粉 溶液中逐滴加入氯水(含
溶液中逐滴加入氯水(含 ),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2:
),观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_______;猜想2: 被
被 继续氧化(为
继续氧化(为 )。
)。| 序号 | 实验操作 | 试剂 | 观察实验现象 | 结论 |
| 1 | 分别取少量褪色后溶液于三支试管中,并加入对应试剂 | a | 溶液变蓝 | 猜想1不正确 |
| 2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确 | |
| 3 | 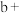 稀 稀 | 溶液变蓝 |
 为
为②试剂b是一种可溶性含碘化合物,该反应的离子方程式为
(5)已知下列四种氧化剂(均可氧化
 )对应的还原产物情况如下:
)对应的还原产物情况如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  |  |
 作用,得到
作用,得到 最多的是
最多的是(6)结合上述信息思考:对于
 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入(7)
 具有很强的氧化性(还原产物为
具有很强的氧化性(还原产物为 ),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是
),常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是 的
的
您最近一年使用:0次
解题方法
6 . I.高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
(1)Na2FeO4中铁元素的化合价是____ 价,Na2FeO4具有较强的____ (填“氧化性”或“还原性”)。
(2)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:____ 。
2FeCl3+10NaOH+3NaClO=2____+5____+9____
II.钒触媒(V2O5)是催化氧化所常用的催化剂,为综合利用,科研人员最新研制了一种离子交换法回收废钒的新工艺,回收率达90%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料可知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图。
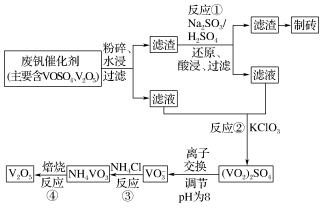
(3)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施:____ 、____ (写出2条)。
(4)写出反应①的离子方程式____ 。
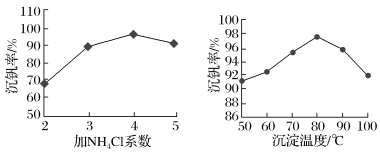
(5)该工艺中反应③的沉矾率是回收钒的关键,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据如图建议最合适的氯化铵系数和温度:氯化铵系数为____ ,温度为____ 。
(6)写出“焙烧反应④”中由NH4VO3制备V2O5的化学方程式____ 。
(1)Na2FeO4中铁元素的化合价是
(2)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:
2FeCl3+10NaOH+3NaClO=2____+5____+9____
II.钒触媒(V2O5)是催化氧化所常用的催化剂,为综合利用,科研人员最新研制了一种离子交换法回收废钒的新工艺,回收率达90%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料可知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图。

(3)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施:
(4)写出反应①的离子方程式
(5)该工艺中反应③的沉矾率是回收钒的关键,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据如图建议最合适的氯化铵系数和温度:氯化铵系数为

(6)写出“焙烧反应④”中由NH4VO3制备V2O5的化学方程式
您最近一年使用:0次
名校
7 . I. Fe2O3又称铁红,请根据要求完成下列问题。
(1)Fe2O3固体(红棕色)属于___________ (填“纯净物”或“混合物”)。将其加入适量盐酸中,反应的离子方程式为:_______________________________________ 。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向烧杯中加入几滴FeCl3饱和溶液,继续煮沸至出现___________ 色,即可制得Fe(OH)3胶体。
(3)另取一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡摇匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到___________ 烧杯的液体中产生了丁达尔效应。
II.亚硝酸钠( )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。
(4) 中
中 元素的化合价是
元素的化合价是_________ ,根据 的化合价,推测
的化合价,推测 具有
具有_________ (填“氧化性”、“还原性”或“氧化性和还原性”)。
(5)该化学兴趣小组为了验证推测的结果,设计实验操作如下表所示,请完善表格中的实验现象和结论(已知I2遇淀粉变蓝)。
(6)通过上述实验可知, 、
、 、I2的氧化性由强到弱的顺序为
、I2的氧化性由强到弱的顺序为____________ 。
(7)根据我国食品添加剂使用标准,亚硝酸钠在肉制品中的最大使用量是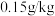 ;则
;则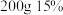 的
的 溶液最少可生产的肉制品的质量为
溶液最少可生产的肉制品的质量为_______ kg。
(1)Fe2O3固体(红棕色)属于
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向烧杯中加入几滴FeCl3饱和溶液,继续煮沸至出现
(3)另取一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡摇匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到
II.亚硝酸钠(
 )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。(4)
 中
中 元素的化合价是
元素的化合价是 的化合价,推测
的化合价,推测 具有
具有(5)该化学兴趣小组为了验证推测的结果,设计实验操作如下表所示,请完善表格中的实验现象和结论(已知I2遇淀粉变蓝)。
实验 | 实验操作及现象或结果 | 结论 |
① | 取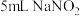 溶液于试管中,加入少量 溶液于试管中,加入少量 溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 |  具有 具有 |
② | 取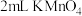 溶液(先酸化好)于试管中,滴加足量的 溶液(先酸化好)于试管中,滴加足量的 溶液,可观察到的实验现象为 溶液,可观察到的实验现象为 |  具有还原性 具有还原性 |
③ |  固体与70%硫酸反应生成了 固体与70%硫酸反应生成了 和 和 两种气体 两种气体 |  具有 具有 |
 、
、 、I2的氧化性由强到弱的顺序为
、I2的氧化性由强到弱的顺序为(7)根据我国食品添加剂使用标准,亚硝酸钠在肉制品中的最大使用量是
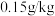 ;则
;则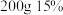 的
的 溶液最少可生产的肉制品的质量为
溶液最少可生产的肉制品的质量为
您最近一年使用:0次
名校
8 . 亚硝酸钠(NaNO2)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究NaNO2的性质。
(1)NaNO2中N元素的化合价是___________ ,根据化合价,推测其具有氧化性和还原性。
(2)化学兴趣小组为了验证推测的结果,设计实验操作如下表所示,请完善表格中的实验现象和结论(已知I2遇淀粉变蓝)。
(3)通过上述实验可知,NaNO2、KMnO4、I2的氧化性由强到弱的顺序为___________ 。
(1)NaNO2中N元素的化合价是
(2)化学兴趣小组为了验证推测的结果,设计实验操作如下表所示,请完善表格中的实验现象和结论(已知I2遇淀粉变蓝)。
| 实验 | 实验操作及现象 | 结论 |
| ① | 取5mLNaNO2溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 | NaNO2具有 |
| ② | 取2mLKMnO4溶液(先酸化好)于试管中,滴加足量的NaNO2溶液,可观察到的实验现象为 | NaNO2具有还原性 |
| ③ | NaNO2固体与70%硫酸反应生成了NO和NO2两种气体 | NaNO2具有 |
您最近一年使用:0次
2023-11-17更新
|
37次组卷
|
2卷引用:四川省成都市成飞中学2023-2024学年高一上学期10月月考化学试题
名校
9 . 铊 是某超导体材料的组成元素之一,
是某超导体材料的组成元素之一, 与
与 在酸性介质中发生反应
在酸性介质中发生反应 。
。
(1)铊 的原子序数为81,铊在元素周期表中位于第
的原子序数为81,铊在元素周期表中位于第___________ 周期第___________ 族。
(2)铊与下列某种元素位于同一主族,该元素是___________ 。
A.硼 B.氮 C.碳 D.氟
(3)下列推断正确的是___________ (填序号)。
A.单质的还原性: B.原子半径:
B.原子半径:
C.碱性: D.氧化性:
D.氧化性:
E. 最外层只有1个电子
最外层只有1个电子
(4) 元素是与铝属于“对角线关系”的第二周期元素,二者的单质化学性质很相似。试写出
元素是与铝属于“对角线关系”的第二周期元素,二者的单质化学性质很相似。试写出 与
与 溶液反应的化学方程式是
溶液反应的化学方程式是___________ 。
 是某超导体材料的组成元素之一,
是某超导体材料的组成元素之一, 与
与 在酸性介质中发生反应
在酸性介质中发生反应 。
。(1)铊
 的原子序数为81,铊在元素周期表中位于第
的原子序数为81,铊在元素周期表中位于第(2)铊与下列某种元素位于同一主族,该元素是
A.硼 B.氮 C.碳 D.氟
(3)下列推断正确的是
A.单质的还原性:
 B.原子半径:
B.原子半径:
C.碱性:
 D.氧化性:
D.氧化性:
E.
 最外层只有1个电子
最外层只有1个电子(4)
 元素是与铝属于“对角线关系”的第二周期元素,二者的单质化学性质很相似。试写出
元素是与铝属于“对角线关系”的第二周期元素,二者的单质化学性质很相似。试写出 与
与 溶液反应的化学方程式是
溶液反应的化学方程式是
您最近一年使用:0次
名校
10 . 下列实验现象及结论均正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 氯化亚铁溶液中滴加酸性KMnO4溶液 | KMnO4溶液褪色 | 亚铁离子具有还原性 |
| B | 向溴化钾溶液中加入过量的新制氯水,再加入碘化钾淀粉溶液 | 溶液变成蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 向某待测液中加入氢氧化钠溶液 | 产生白色沉淀 | 溶液中含有Fe2+ |
| D | 向某溶液中加入盐酸,无现象,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中含SO42- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



