解题方法
1 . Ⅰ.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是___________ 。(写化学式)
(2)步骤②中的离子方程式___________ 。
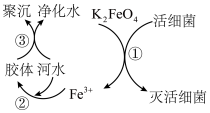
Ⅱ.高铁酸钾(极易溶于水)是优良的水处理剂,其原理如图所示:___________ (填“氧化”或“还原”)性;根据上述原理分析,K2FeO4作水处理剂净化水的过程中利用了Fe(OH)3胶体的性质,请写出Fe(OH)3胶体制备的化学方程式:___________ 。
Ⅲ.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3XO2与NaOH反应最多生成两种盐。
(4)H3XO2属于___________ (填编号)。
①一元酸 ②二元酸 ③三元酸
(5)写出 H3XO2溶液与少量NaOH溶液反应的化学方程式___________ 。
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是
(2)步骤②中的离子方程式
Ⅱ.高铁酸钾(极易溶于水)是优良的水处理剂,其原理如图所示:
Ⅲ.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3XO2与NaOH反应最多生成两种盐。
(4)H3XO2属于
①一元酸 ②二元酸 ③三元酸
(5)写出 H3XO2溶液与少量NaOH溶液反应的化学方程式
您最近一年使用:0次
名校
2 . 从冶炼金属产生的某酸泥(含 单质,
单质, 及锌、铜的化合物等)中回收汞和硒的一种工艺如下:
及锌、铜的化合物等)中回收汞和硒的一种工艺如下: 、
、 、
、 、
、 形式进入溶液。
形式进入溶液。 固体的晶体类型与石墨的晶体类型
固体的晶体类型与石墨的晶体类型___________ 相同(填“是”或者“不”);分离氧化浸出液和浸出渣的操作是___________ 。
2.还原沉汞时加入的 属于正盐,则
属于正盐,则 属于
属于___________ 元酸:沉汞后溶液中磷以最高价形式存在,“还原沉汞”的主要反应中氧化剂和还原剂的物质的量之比为___________ 。
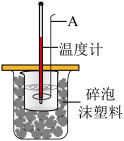
3.实验室测定中和反应热效应的装置如图所示,该装置有利于减少实验误差的设计措施有___________ (至少写一条)。
i.取 粗硒于锥形瓶中,加入
粗硒于锥形瓶中,加入 浓盐酸和
浓盐酸和 浓硝酸,沸水浴加热,使
浓硝酸,沸水浴加热,使 全部转化为
全部转化为 ;
;
ii.除去过量的 和溶解的
和溶解的 ;
;
iii. 加入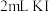 溶液、
溶液、 淀粉溶液,然后用
淀粉溶液,然后用 标准溶液进行滴定,到达滴定终点时,消耗
标准溶液进行滴定,到达滴定终点时,消耗 标准溶液
标准溶液 。
。
已知:
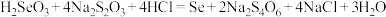

4.滴定时使用的定量仪器为___________ ,到达滴定终点时的现象为___________ 。
5.根据实验数据计算粗硒中硒的纯度为___________ 。
 单质,
单质, 及锌、铜的化合物等)中回收汞和硒的一种工艺如下:
及锌、铜的化合物等)中回收汞和硒的一种工艺如下: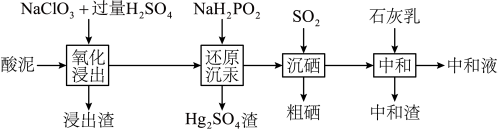
 、
、 、
、 、
、 形式进入溶液。
形式进入溶液。 固体的晶体类型与石墨的晶体类型
固体的晶体类型与石墨的晶体类型2.还原沉汞时加入的
 属于正盐,则
属于正盐,则 属于
属于3.实验室测定中和反应热效应的装置如图所示,该装置有利于减少实验误差的设计措施有
i.取
 粗硒于锥形瓶中,加入
粗硒于锥形瓶中,加入 浓盐酸和
浓盐酸和 浓硝酸,沸水浴加热,使
浓硝酸,沸水浴加热,使 全部转化为
全部转化为 ;
;ii.除去过量的
 和溶解的
和溶解的 ;
;iii. 加入
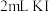 溶液、
溶液、 淀粉溶液,然后用
淀粉溶液,然后用 标准溶液进行滴定,到达滴定终点时,消耗
标准溶液进行滴定,到达滴定终点时,消耗 标准溶液
标准溶液 。
。已知:

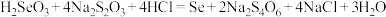

4.滴定时使用的定量仪器为
5.根据实验数据计算粗硒中硒的纯度为
您最近一年使用:0次
名校
3 . 亚氯酸钠( )是高效氧化剂和漂白剂,其制备流程如下:
)是高效氧化剂和漂白剂,其制备流程如下: 在温度高于60℃时易分解生成
在温度高于60℃时易分解生成 和
和 。
。
② (沸点11℃)浓度高时易发生分解爆炸,可用气体稀释至含量
(沸点11℃)浓度高时易发生分解爆炸,可用气体稀释至含量 以下。
以下。 极易溶于水,具有强灭菌作用。
极易溶于水,具有强灭菌作用。
③ 在酸性溶液中发生歧化反应,离子方程式为:
在酸性溶液中发生歧化反应,离子方程式为:
(1)写出 溶于水电离方程式:
溶于水电离方程式:___________ 。
(2)推测发生器中鼓入空气的作用可能是___________ 。
(3)若吸收塔内反应过程中转移 个电子,则生成标准状况下氧气的体积为___________L。
个电子,则生成标准状况下氧气的体积为___________L。
(4)吸收塔的温度需控制在10℃以下,其原因是___________ 、___________ (列举两点)。
(5)取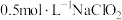 溶液,调节溶液
溶液,调节溶液 ,再加入适量
,再加入适量 溶液,发现灭菌作用明显增强。请用化学平衡移动原理解释原因。
溶液,发现灭菌作用明显增强。请用化学平衡移动原理解释原因。___________ 。
(6)从 溶液中获得
溶液中获得 无水晶体的过程中对温度的控制要求较高。操作时先减压,再将
无水晶体的过程中对温度的控制要求较高。操作时先减压,再将 溶液加热浓缩,浓缩时的最佳温度为___________。
溶液加热浓缩,浓缩时的最佳温度为___________。
已知 的溶解度随温度变化曲线如图所示。
的溶解度随温度变化曲线如图所示。
(7)当加热浓缩至有晶膜出现时,再在常压下___________ (填操作)、过滤、洗涤、干燥。
 )是高效氧化剂和漂白剂,其制备流程如下:
)是高效氧化剂和漂白剂,其制备流程如下: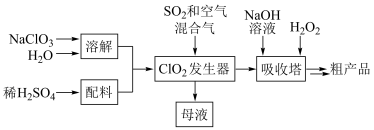
 在温度高于60℃时易分解生成
在温度高于60℃时易分解生成 和
和 。
。②
 (沸点11℃)浓度高时易发生分解爆炸,可用气体稀释至含量
(沸点11℃)浓度高时易发生分解爆炸,可用气体稀释至含量 以下。
以下。 极易溶于水,具有强灭菌作用。
极易溶于水,具有强灭菌作用。③
 在酸性溶液中发生歧化反应,离子方程式为:
在酸性溶液中发生歧化反应,离子方程式为:
(1)写出
 溶于水电离方程式:
溶于水电离方程式:(2)推测发生器中鼓入空气的作用可能是
(3)若吸收塔内反应过程中转移
 个电子,则生成标准状况下氧气的体积为___________L。
个电子,则生成标准状况下氧气的体积为___________L。| A.11.2 | B.22.4 | C.33.6 | D.44.8 |
(4)吸收塔的温度需控制在10℃以下,其原因是
(5)取
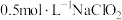 溶液,调节溶液
溶液,调节溶液 ,再加入适量
,再加入适量 溶液,发现灭菌作用明显增强。请用化学平衡移动原理解释原因。
溶液,发现灭菌作用明显增强。请用化学平衡移动原理解释原因。(6)从
 溶液中获得
溶液中获得 无水晶体的过程中对温度的控制要求较高。操作时先减压,再将
无水晶体的过程中对温度的控制要求较高。操作时先减压,再将 溶液加热浓缩,浓缩时的最佳温度为___________。
溶液加热浓缩,浓缩时的最佳温度为___________。已知
 的溶解度随温度变化曲线如图所示。
的溶解度随温度变化曲线如图所示。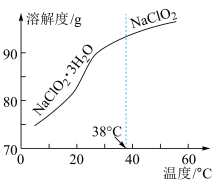
| A.略低于38℃ | B.略高于38℃ | C.略低于60℃ | D.略高于60℃ |
(7)当加热浓缩至有晶膜出现时,再在常压下
您最近一年使用:0次
名校
4 . 过量使用尿素[CO(NH2)2]会造成水体中氨氮(以 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法
(1)写出上述反应的离子方程式。___________ 。
(2)若收集到标况下 气体,转移电子的数目为
气体,转移电子的数目为___________ 。
(3)氨氮去除率随 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是___________ 。
(4)某废水中氨氮浓度(以 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为______ ?(写出计算过程)
 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法(1)写出上述反应的离子方程式。
(2)若收集到标况下
 气体,转移电子的数目为
气体,转移电子的数目为(3)氨氮去除率随
 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是(4)某废水中氨氮浓度(以
 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为
您最近一年使用:0次
名校
解题方法
5 . 高铁酸钾 是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体,反应原理:
是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体,反应原理: 。
。
(1)胶体分散质粒子的直径范围是_________ 。该反应中 是
是_________ 。
A.还原剂 B.氧化剂 C.被还原 D.被氧化
(2) 能杀灭水中细菌的原因是
能杀灭水中细菌的原因是___________ 。
(3)配平湿法制高铁酸钾的离子反应方程式_________ 。
___________Fe(OH)3+___________ClO-+__________ ___________
___________ +___________
+___________ + ___________。
+ ___________。
 是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体,反应原理:
是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体,反应原理: 。
。(1)胶体分散质粒子的直径范围是
 是
是A.还原剂 B.氧化剂 C.被还原 D.被氧化
(2)
 能杀灭水中细菌的原因是
能杀灭水中细菌的原因是(3)配平湿法制高铁酸钾的离子反应方程式
___________Fe(OH)3+___________ClO-+__________
 ___________
___________ +___________
+___________ + ___________。
+ ___________。
您最近一年使用:0次
名校
6 . 已知:① (绿色)(强碱性条件)
(绿色)(强碱性条件)
② (强酸性条件)
(强酸性条件)
(1)在KOH溶液中, 与
与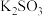 溶液发生反应,还原剂为
溶液发生反应,还原剂为___________ ,还原产物为___________ 。
(2)将 溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式
溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式___________ 。
(3)向20mL浓度为0.02mol/L的 溶液中滴加
溶液中滴加 溶液,使
溶液,使 全部转化为
全部转化为 ,则反应前需向
,则反应前需向 溶液加入
溶液加入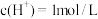 的酸不少于
的酸不少于___________ mL。
 (绿色)(强碱性条件)
(绿色)(强碱性条件)②
 (强酸性条件)
(强酸性条件)(1)在KOH溶液中,
 与
与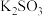 溶液发生反应,还原剂为
溶液发生反应,还原剂为(2)将
 溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式
溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式(3)向20mL浓度为0.02mol/L的
 溶液中滴加
溶液中滴加 溶液,使
溶液,使 全部转化为
全部转化为 ,则反应前需向
,则反应前需向 溶液加入
溶液加入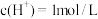 的酸不少于
的酸不少于
您最近一年使用:0次
名校
解题方法
7 . 土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:
(1) 、
、 、
、 、O元素的原子半径从大到小的顺序是
、O元素的原子半径从大到小的顺序是_______ 。
(2)上述反应中的各物质属于共价化合物是_______ ;氧化剂是_______ 。氮气的电子式是_______ 。
(3)非金属性S_______ O(写“ ”或“
”或“ ”)。用一个化学方程式证明硫与氧的非金属性强弱:
”)。用一个化学方程式证明硫与氧的非金属性强弱:_______ 。
(4)配平上述反应方程式,并标出电子转移的方向和数目。_______
_______ _______
_______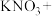 _______
_______ _______
_______ _______
_______ _______
_______

(1)
 、
、 、
、 、O元素的原子半径从大到小的顺序是
、O元素的原子半径从大到小的顺序是(2)上述反应中的各物质属于共价化合物是
(3)非金属性S
 ”或“
”或“ ”)。用一个化学方程式证明硫与氧的非金属性强弱:
”)。用一个化学方程式证明硫与氧的非金属性强弱:(4)配平上述反应方程式,并标出电子转移的方向和数目。
_______
 _______
_______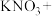 _______
_______ _______
_______ _______
_______ _______
_______
您最近一年使用:0次
名校
解题方法
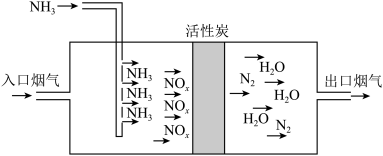
8 . 活性炭吸附脱硝法的工艺流程如图所示。___________ ,若入口烟气中 以
以 形式参加反应,则相应的化学方程式为
形式参加反应,则相应的化学方程式为___________ 。
 以
以 形式参加反应,则相应的化学方程式为
形式参加反应,则相应的化学方程式为
您最近一年使用:0次
名校
9 . 化学社团的学生们查阅相关资料并设计了如下装置制备亚硝酰氯(NOCl)。 。
。
②亚硝酰氯熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应。
1.装置的连接顺序为a→b→c→___________ →h,实验时先打开分液漏斗活塞滴入稀硝酸,当观察到F中___________ 时,开始向装置中通入 。
。
2.写出A中发生的化学方程式___________ 。
3.装置B的作用是___________ ,装置D中长颈漏斗的作用是___________ 。
制得的亚硝酰氯(NOCl)中可能含有少量杂质,化学社团的同学们设计了如下实验测定NOCl的纯度。
①取5.000g,三颈烧瓶中所得产物溶于适量氢氧化钠溶液中,然后加入一定量稀硫酸和KI溶液,并通入足量 ,将NO全部赶出,最后将溶液稀释至500.00mL;
,将NO全部赶出,最后将溶液稀释至500.00mL;
②取25.00mL上述所得溶液,用淀粉作指示剂,用0.15
 标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。
已知:
①
②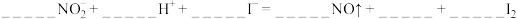
③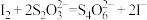
4.补充并配平反应②并标出电子转移的方向和数目___________ 。
5.滴定终点的现象___________ ,结合相关数据,计算实验测得产品中NOCl的纯度为___________ (保留三位小数)。
6.下列操作将导致NOCl纯度测量偏低的是___________。

 。
。②亚硝酰氯熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应。
1.装置的连接顺序为a→b→c→
 。
。2.写出A中发生的化学方程式
3.装置B的作用是
制得的亚硝酰氯(NOCl)中可能含有少量杂质,化学社团的同学们设计了如下实验测定NOCl的纯度。
①取5.000g,三颈烧瓶中所得产物溶于适量氢氧化钠溶液中,然后加入一定量稀硫酸和KI溶液,并通入足量
 ,将NO全部赶出,最后将溶液稀释至500.00mL;
,将NO全部赶出,最后将溶液稀释至500.00mL;②取25.00mL上述所得溶液,用淀粉作指示剂,用0.15

 标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。已知:
①

②
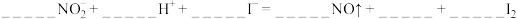
③
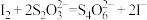
4.补充并配平反应②并标出电子转移的方向和数目
5.滴定终点的现象
6.下列操作将导致NOCl纯度测量偏低的是___________。
A.滴定过程中剧烈振荡导致 挥发 挥发 |
| B.滴定前滴定管有气泡,滴定后气泡消失 |
| C.锥形瓶用待测液润洗 |
D.滴定管用蒸馏水润洗后,直接加入 标准溶液进行滴定 标准溶液进行滴定 |
您最近一年使用:0次
名校
解题方法
10 . 钠、铝等金属及其材料在人类文明进步和社会发展中发挥了重要的作用。
(1)请用一个离子方程式说明钠与铝的金属性强弱___________ 。
(2)叠氮化钠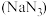 是一种无色结晶,其固体中正负离子的个数比为
是一种无色结晶,其固体中正负离子的个数比为 ,则该固体中含有的化学键是
,则该固体中含有的化学键是___________ (填化学键名称)。叠氮化钠受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32L(标准状况下)氮气,至少需要叠氮化钠___________ g。
(3)在含0.1molNaOH的溶液中不断地通入 ,得到溶质的质量为8.35g,则烧杯中生产的溶质是
,得到溶质的质量为8.35g,则烧杯中生产的溶质是___________ 。溶质的物质的量是___________ 。
(4)高锰酸根离子 水对人体危害极大,可用过碳酸钠
水对人体危害极大,可用过碳酸钠 改性赤泥进行处理,反应如下:
改性赤泥进行处理,反应如下:
___________ ___________
___________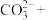 ___________
___________ ___________
___________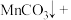 ___________
___________ ___________
___________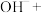 ___________H2O
___________H2O
补全并配平上述化学反应过程式___________ ;反应中,过碳酸钠起沉淀剂和___________ 剂作用;若将1L含Mn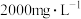 的含高锰酸根离子的废水处理至含Mn
的含高锰酸根离子的废水处理至含Mn ,则转移电子数为
,则转移电子数为___________ mol(保留2位小数)。
(1)请用一个离子方程式说明钠与铝的金属性强弱
(2)叠氮化钠
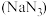 是一种无色结晶,其固体中正负离子的个数比为
是一种无色结晶,其固体中正负离子的个数比为 ,则该固体中含有的化学键是
,则该固体中含有的化学键是(3)在含0.1molNaOH的溶液中不断地通入
 ,得到溶质的质量为8.35g,则烧杯中生产的溶质是
,得到溶质的质量为8.35g,则烧杯中生产的溶质是(4)高锰酸根离子
 水对人体危害极大,可用过碳酸钠
水对人体危害极大,可用过碳酸钠 改性赤泥进行处理,反应如下:
改性赤泥进行处理,反应如下:___________
 ___________
___________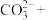 ___________
___________ ___________
___________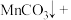 ___________
___________ ___________
___________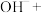 ___________H2O
___________H2O补全并配平上述化学反应过程式
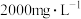 的含高锰酸根离子的废水处理至含Mn
的含高锰酸根离子的废水处理至含Mn ,则转移电子数为
,则转移电子数为
您最近一年使用:0次



