名校
解题方法
1 . 锰元素在一些有机物的氧化过程中会以中间体形式出现一种美丽的亮蓝色离子MnO (次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下:
(次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下:
(1)次锰酸根离子MnO 中Mn的化合价为
中Mn的化合价为___________ 。
(2)“焙烧”过程中的氧化剂为___________ 、___________ (填化学式)。
(3)“除铝”过程中的离子方程式为___________ 。
(4)“滤渣2”的主要成分为___________ 、___________ (填化学式)。
(5)“沉锰”时,Mn2+会转化为MnCO3.若常温下控制溶液pH=8,且最终c(HCO )=0.1 mol·L-1,则此时溶液中c(Mn2+)=
)=0.1 mol·L-1,则此时溶液中c(Mn2+)=___________ mol·L-1。
(6)在“共熔”过程中,需要向煅烧后产生的MnO2固体中添加一定比例的NaNO3、NaOH,反应得到Na2MnO4及一种单质气体,则该反应的化学方程式为___________ 。
 (次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下:
(次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下: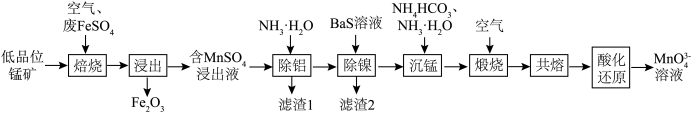
| 物质 | MnCO3 | H2CO3 |
| 25℃数值 | Ksp=2.0×10-11 | Ka1=4×10-7 Ka2=5×10-11 |
(1)次锰酸根离子MnO
 中Mn的化合价为
中Mn的化合价为(2)“焙烧”过程中的氧化剂为
(3)“除铝”过程中的离子方程式为
(4)“滤渣2”的主要成分为
(5)“沉锰”时,Mn2+会转化为MnCO3.若常温下控制溶液pH=8,且最终c(HCO
 )=0.1 mol·L-1,则此时溶液中c(Mn2+)=
)=0.1 mol·L-1,则此时溶液中c(Mn2+)=(6)在“共熔”过程中,需要向煅烧后产生的MnO2固体中添加一定比例的NaNO3、NaOH,反应得到Na2MnO4及一种单质气体,则该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 水中溶解的氧气高温下对锅炉有很强的腐蚀性,可以用联氨(N2H4)处理锅炉水中的溶解氧。其中一种反应机理如图所示。下列说法错误的是

| A.联氨(N2H4)易溶于水,所得溶液中存在四种氢键 |
| B.稳定性:H2O2<N2H4,是因为H2O2分子中孤电子对较多 |
C.①中发生的反应为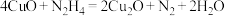 |
D.该过程中产生的氮气和消耗的氧气之比为: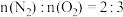 |
您最近一年使用:0次
2024-04-05更新
|
168次组卷
|
2卷引用:宁夏银川市贺兰县第一中学2023-2024学年高二下学期第一阶段考试化学试卷
名校
3 . 2023年10月26日11时14分,神舟十七号载人飞船在酒泉卫星发射中心点火发射。飞船返回地球时,为了减弱返回舱着陆的速度,反推发动机的燃料是高氯酸铵 和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
(1)二氧化氯 和过氧化氢均有强氧化性。
和过氧化氢均有强氧化性。
①Cl和O分别形成简单氢化物的稳定性比较_______ >_______
②在酸性条件下,由 和双氧水反应制备
和双氧水反应制备 ,其反应的离子方程式为
,其反应的离子方程式为_______ ;该反应中还原剂与氧化剂的物质的量之比为_______ 。
(2)高氯酸铵中铵根离子的电子式为_______ ;高氯酸铵和铝粉中的元素所形成的简单离子中,核外电子数相同、半径由小到大的顺序是_______ (用离子符号表示)。
(3)氮元素的非金属性较强,N2分子的性质比较稳定,其原因是_______ 。
(4)高氯酸铵和铝粉反应除了生成 和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式_______ 。
 和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:(1)二氧化氯
 和过氧化氢均有强氧化性。
和过氧化氢均有强氧化性。①Cl和O分别形成简单氢化物的稳定性比较
②在酸性条件下,由
 和双氧水反应制备
和双氧水反应制备 ,其反应的离子方程式为
,其反应的离子方程式为(2)高氯酸铵中铵根离子的电子式为
(3)氮元素的非金属性较强,N2分子的性质比较稳定,其原因是
(4)高氯酸铵和铝粉反应除了生成
 和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
您最近一年使用:0次
名校
4 . 硫代硫酸钠( )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:
(1) 能解毒氰化物的原理为
能解毒氰化物的原理为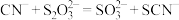 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入___________ (填化学式),观察到的现象是___________ 。
(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
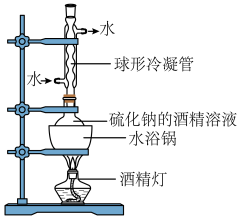
图1
将工业硫化钠溶于酒精并加热时,采取水浴加热优点是___________ 。
(3)利用图2装置制备 。
。
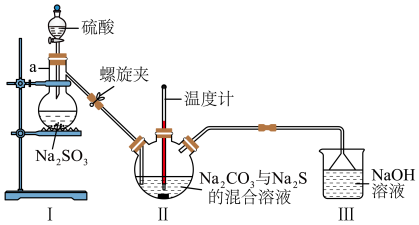
图2
①仪器a的名称为___________ 。
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以___________ 。
③装置Ⅱ处发生反应的总化学方程式为___________ ,停止通入 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是___________ 。
④装置 Ⅲ 的作用是___________ 。
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中 (
( )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用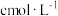 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为VmL。(已知
标准溶液的体积为VmL。(已知 )
)
①滴定达到终点时的现象是___________ 。
②产品中 的质量分数为
的质量分数为___________ %。
 )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:(1)
 能解毒氰化物的原理为
能解毒氰化物的原理为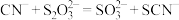 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。

图1
将工业硫化钠溶于酒精并加热时,采取水浴加热优点是
(3)利用图2装置制备
 。
。
图2
①仪器a的名称为
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以
③装置Ⅱ处发生反应的总化学方程式为
 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是④装置 Ⅲ 的作用是
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中
 (
( )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用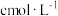 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为VmL。(已知
标准溶液的体积为VmL。(已知 )
)①滴定达到终点时的现象是
②产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024-02-13更新
|
95次组卷
|
2卷引用:宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题
名校
解题方法
5 . 废弃电池是一种有害垃圾,合理处理则能变废为宝。下图是废弃锌锰电池的处理流程图:
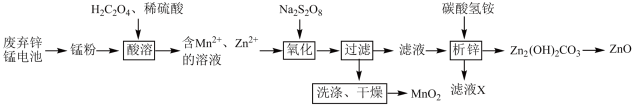
已知:锰粉的主要成分是Mn元素的+2、+3、+4价氧化物和ZnO。
回答下列问题:
(1)“废弃锌锰电池→锰粉”的操作是拆分、煅烧,煅烧类似于实验室中的焙烧,实验室焙烧使用的仪器名称是___________ 。
(2)“酸溶”采用锰粉比锰块的浸取速率快,为提高“酸溶”的浸取速率,还可以采取的措施有___________ (任写两条),
(3)“酸溶” 过程中H2C2O4与Mn元素+4价氧化物反应的离子方程式___________ ,“氧化”操作的氧化产物是___________ (填化学式)。
(4)“洗涤、干燥”时,检验MnO2洗涤干净的实验方法及现象是___________ 。
(5)滤液X可以用于制取化肥,其中除Na+外,主要含___________ 、 (填离子符号)。
(填离子符号)。
(6)由Zn2(OH)2CO3制备ZnO的条件是加热,写出该反应的化学方程式:___________ 。

已知:锰粉的主要成分是Mn元素的+2、+3、+4价氧化物和ZnO。
回答下列问题:
(1)“废弃锌锰电池→锰粉”的操作是拆分、煅烧,煅烧类似于实验室中的焙烧,实验室焙烧使用的仪器名称是
(2)“酸溶”采用锰粉比锰块的浸取速率快,为提高“酸溶”的浸取速率,还可以采取的措施有
(3)“酸溶” 过程中H2C2O4与Mn元素+4价氧化物反应的离子方程式
(4)“洗涤、干燥”时,检验MnO2洗涤干净的实验方法及现象是
(5)滤液X可以用于制取化肥,其中除Na+外,主要含
 (填离子符号)。
(填离子符号)。(6)由Zn2(OH)2CO3制备ZnO的条件是加热,写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
6 . 如图是硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:

请回答下列问题:
(1)酸浸时,将硫铁矿烧渣粉碎的原因是___________ 。
(2)酸浸、过滤后滤液A中的金属阳离子是___________ 。
(3)煅烧FeCO3生成产品I的化学方程式为___________ 。
(4)产品Ⅱ的化学式为___________ 。
(5)写出步骤Ⅳ反应的离子方程式___________ 。

请回答下列问题:
(1)酸浸时,将硫铁矿烧渣粉碎的原因是
(2)酸浸、过滤后滤液A中的金属阳离子是
(3)煅烧FeCO3生成产品I的化学方程式为
(4)产品Ⅱ的化学式为
(5)写出步骤Ⅳ反应的离子方程式
您最近一年使用:0次
名校
解题方法
7 . 用硝酸氧化蔗糖水解的产物可以制备草酸。实验过程如下:

①将蔗糖溶液与少许硫酸混合水浴加热;
②控制反应温度,边搅拌边缓慢滴加混酸(65% HNO3、98% H2SO4的混合溶液),装置如图1所示(加热、搅拌和仪器固定装置均已略去);
硝酸氧化蔗糖水解液过程中发生反应:C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
请回答下列问题:
(1)实验①加入少许硫酸的目的是___________ 。
(2)冷凝水进水方向是___________ 口(填“a”或“b”)。
(3)利用草酸晶体分解制备CO的原理为H2C2O4•xH2O CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有
CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有 ___________ 和 ___________ 的洗气瓶。
(4)将产品在90℃以下的恒温箱内烘干至恒重,得到二水合草酸。用酸性KMnO4标准溶液滴定,反应的离子方程式为2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为 ___________ 。滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为 ___________ 。

①将蔗糖溶液与少许硫酸混合水浴加热;
②控制反应温度,边搅拌边缓慢滴加混酸(65% HNO3、98% H2SO4的混合溶液),装置如图1所示(加热、搅拌和仪器固定装置均已略去);
硝酸氧化蔗糖水解液过程中发生反应:C6H12O6+12HNO3
 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O请回答下列问题:
(1)实验①加入少许硫酸的目的是
(2)冷凝水进水方向是
(3)利用草酸晶体分解制备CO的原理为H2C2O4•xH2O
 CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有
CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有 (4)将产品在90℃以下的恒温箱内烘干至恒重,得到二水合草酸。用酸性KMnO4标准溶液滴定,反应的离子方程式为2MnO
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
您最近一年使用:0次
解题方法
8 . 下列离子方程式正确的是
A.电解MgCl2溶液:Mg2++2Cl- Mg+Cl2↑ Mg+Cl2↑ |
| B.使用K3[Fe(CN)6]检验Fe2+:2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓ |
C.泡沫灭火器工作原理:2Al3++3CO +3H2O=2Al(OH)3↓+3CO2↑ +3H2O=2Al(OH)3↓+3CO2↑ |
D.用醋酸和淀粉-KI溶液检验加碘盐中的IO :IO :IO +5I-+6H+=3I2+3H2O +5I-+6H+=3I2+3H2O |
您最近一年使用:0次
9 . ClNO(亚硝酰氯)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,ClNO的熔点为−64.5℃、沸点为−5.5℃,气态呈黄色,液态时呈红褐色,遇水发生水解反应生成一种氯化物和两种氮的常见氧化物,其中一种呈红棕色。回答下列问题:
Ⅰ.ClNO的制备:实验室中可用如图所示装置制备ClNO。
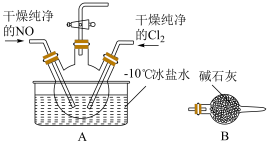
(1)①装置A中盛装液体的仪器名称:___________
②装置A中−10℃冰盐水的作用是:___________
(2)①实验室常用MnO2和浓盐酸反应制取氯气,写出该反应的离子方程式:___________ ;实验开始时应先通入Cl2,让三颈瓶中充满黄绿色,再将NO缓缓通入。先通入Cl2的目的是___________
(3)装置B除了进行尾气处理外,另一个作用是___________
Ⅱ.ClNO纯度的测定:取所制备的亚硝酰氯13.10g溶于水配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol∙L−1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL(已知:Ag2CrO4为砖红色固体)。
(4)ClNO与水反应的化学方程式为___________ 。
(5)滴定终点的实验现象为___________ 。
(6)ClNO的质量分数为___________ 。
Ⅰ.ClNO的制备:实验室中可用如图所示装置制备ClNO。

(1)①装置A中盛装液体的仪器名称:
②装置A中−10℃冰盐水的作用是:
(2)①实验室常用MnO2和浓盐酸反应制取氯气,写出该反应的离子方程式:
(3)装置B除了进行尾气处理外,另一个作用是
Ⅱ.ClNO纯度的测定:取所制备的亚硝酰氯13.10g溶于水配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol∙L−1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL(已知:Ag2CrO4为砖红色固体)。
(4)ClNO与水反应的化学方程式为
(5)滴定终点的实验现象为
(6)ClNO的质量分数为
您最近一年使用:0次
2023-12-29更新
|
56次组卷
|
2卷引用:宁夏回族自治区银川市2023-2024学年高三上学期12月联考理科综合试题
名校
解题方法
10 . 通过下列实验以印刷线路板碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)为原料制备还原性物质CuCl。下列说法不正确的是
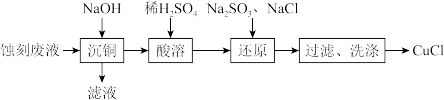

| A.“沉铜”得到的沉淀主要为Cu(OH)2 |
B.“还原”时离子方程式为SO +Cu2++Cl-+H2O=CuCl↓+SO +Cu2++Cl-+H2O=CuCl↓+SO +2H+ +2H+ |
| C.“过滤”、“洗涤”时应该在隔绝空气的条件下进行 |
| D.可循环利用的物质为H2SO4 |
您最近一年使用:0次
2023-11-07更新
|
657次组卷
|
5卷引用:宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题
宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题宁夏银川市西夏区育才中学2023-2024学年高三上学期1月期末化学试题甘肃省兰州第一中学2023-2024学年高三上学期11月期中考试化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)



