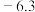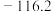名校
解题方法
1 . 我国科研人员将单独脱除 的反应与
的反应与 的制备反应相结合,实现协同转化。
的制备反应相结合,实现协同转化。 :
: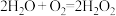 ,不能自发进行
,不能自发进行
②单独脱除 :
: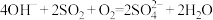 ,能自发进行
,能自发进行
协同转化装置如图(在电场作用下,双极膜中间层的 解离为
解离为 和
和 ,并向两极迁移)。下列分析正确的是
,并向两极迁移)。下列分析正确的是
 的反应与
的反应与 的制备反应相结合,实现协同转化。
的制备反应相结合,实现协同转化。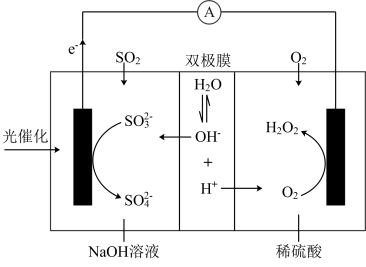
 :
: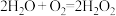 ,不能自发进行
,不能自发进行②单独脱除
 :
: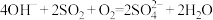 ,能自发进行
,能自发进行协同转化装置如图(在电场作用下,双极膜中间层的
 解离为
解离为 和
和 ,并向两极迁移)。下列分析正确的是
,并向两极迁移)。下列分析正确的是A.该协同转化装置不需要外界能量制备出 |
B.产生 的电极反应: 的电极反应: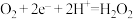 |
C.反应过程中需要补加稀 |
D.协同转化总反应: |
您最近一年使用:0次
名校
解题方法
2 . 立德粉(主要成分为BaSO4 ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:
ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:___________ 。
(2)加入H2O2发生反应的离子方程式为___________ 。
(3)分离出Fe(OH)3的实验操作名称为___________ 。
(4)“除杂Ⅱ”中加入过量的锌粉主要除去___________ (填离子符号),该反应的反应类型为___________ 。
(5)“滤渣”的成分是___________ 。
(6)8.34 g绿矾(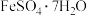 )晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:
)晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示: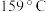 时固体N的化学式为
时固体N的化学式为___________ ,取适量  时所得的样品P,隔绝空气加热至
时所得的样品P,隔绝空气加热至 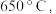 得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式
得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式___________ 。
 ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示:
ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如图所示: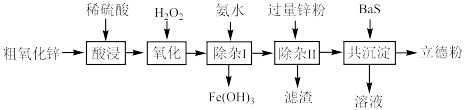
(2)加入H2O2发生反应的离子方程式为
(3)分离出Fe(OH)3的实验操作名称为
(4)“除杂Ⅱ”中加入过量的锌粉主要除去
(5)“滤渣”的成分是
(6)8.34 g绿矾(
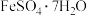 )晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:
)晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示: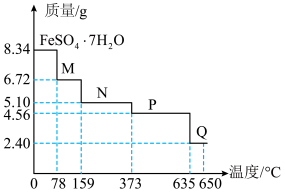
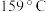 时固体N的化学式为
时固体N的化学式为 时所得的样品P,隔绝空气加热至
时所得的样品P,隔绝空气加热至 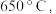 得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式
得到一种红棕色固体物质Q ,同时有两种无色气体生成,请写出该反应的化学方程式
您最近一年使用:0次
7日内更新
|
192次组卷
|
2卷引用:安徽省淮北市龙兴中学2023-2024学年高一上学期期末化学试卷
3 . 纳米 不同于常规
不同于常规 ,由于其晶粒尺寸小,比表面积大,具有优异的物理和化学性质,可用作催化剂脱除废气中的
,由于其晶粒尺寸小,比表面积大,具有优异的物理和化学性质,可用作催化剂脱除废气中的 (胂)(已知:在缺氧条件下,胂受热分解成单质砷)。
(胂)(已知:在缺氧条件下,胂受热分解成单质砷)。
(1)纳米 催化剂的制备:先向
催化剂的制备:先向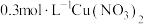 溶液中加入过量氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入
溶液中加入过量氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入 的乙醇溶液生成纳米
的乙醇溶液生成纳米 .
.
已知:i.
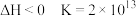 .
.
ⅱ.其他条件相同时,溶液中离子浓度大小影响晶粒生成速率与晶粒生长速率,从而决定了晶粒半径大小.
①反应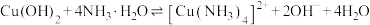 中,
中, 的配位原子为
的配位原子为__________ ,反应的平衡常数
__________ ;
②向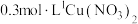 溶液中先加入过量氨水的目的是
溶液中先加入过量氨水的目的是__________ ;
③其他条件不变,产物品粒半径与反应温度的关系如图所示, 时生成
时生成 晶粒的半径较大,可能的原因是
晶粒的半径较大,可能的原因是____________________ ;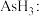
① 主要被废气中的
主要被废气中的 氧化成
氧化成 固体除去,温度低于
固体除去,温度低于 时,氧化生成的固体中砷元素质量分数会升高,原因是
时,氧化生成的固体中砷元素质量分数会升高,原因是____________________ ; 再生:“再生”时需除去纳米
再生:“再生”时需除去纳米 催化剂上的
催化剂上的 和少量
和少量 ,可采用在氮气氛围中加热分解的方法.已知:
,可采用在氮气氛围中加热分解的方法.已知: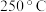 时催化剂上的
时催化剂上的 完全升华;
完全升华; 时催化剂上的
时催化剂上的 完全分解为
完全分解为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为__________ 。
 不同于常规
不同于常规 ,由于其晶粒尺寸小,比表面积大,具有优异的物理和化学性质,可用作催化剂脱除废气中的
,由于其晶粒尺寸小,比表面积大,具有优异的物理和化学性质,可用作催化剂脱除废气中的 (胂)(已知:在缺氧条件下,胂受热分解成单质砷)。
(胂)(已知:在缺氧条件下,胂受热分解成单质砷)。(1)纳米
 催化剂的制备:先向
催化剂的制备:先向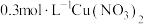 溶液中加入过量氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入
溶液中加入过量氨水,充分搅拌,生成铜氨络合物,再在一定温度下,加入 的乙醇溶液生成纳米
的乙醇溶液生成纳米 .
.已知:i.

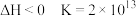 .
.ⅱ.其他条件相同时,溶液中离子浓度大小影响晶粒生成速率与晶粒生长速率,从而决定了晶粒半径大小.
①反应
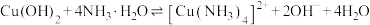 中,
中, 的配位原子为
的配位原子为
②向
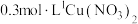 溶液中先加入过量氨水的目的是
溶液中先加入过量氨水的目的是③其他条件不变,产物品粒半径与反应温度的关系如图所示,
 时生成
时生成 晶粒的半径较大,可能的原因是
晶粒的半径较大,可能的原因是
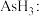
①
 主要被废气中的
主要被废气中的 氧化成
氧化成 固体除去,温度低于
固体除去,温度低于 时,氧化生成的固体中砷元素质量分数会升高,原因是
时,氧化生成的固体中砷元素质量分数会升高,原因是②已知 的结构可表示为
的结构可表示为 ,则
,则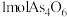 中
中 键物质的量为
键物质的量为 。
。
 再生:“再生”时需除去纳米
再生:“再生”时需除去纳米 催化剂上的
催化剂上的 和少量
和少量 ,可采用在氮气氛围中加热分解的方法.已知:
,可采用在氮气氛围中加热分解的方法.已知: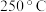 时催化剂上的
时催化剂上的 完全升华;
完全升华; 时催化剂上的
时催化剂上的 完全分解为
完全分解为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
解题方法
4 . 下列解释事实的离子方程式或化学方程式书写错误的是
A.铜在存在 的环境中被氧气腐蚀: 的环境中被氧气腐蚀: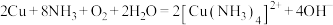 |
B.锌锰碱性电池放电时正极反应式: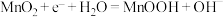 |
C.向冷的石灰乳中通入 制漂白粉: 制漂白粉: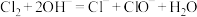 |
D.一定条件下,由乳酸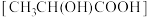 合成聚乳酸的化学方程式: 合成聚乳酸的化学方程式: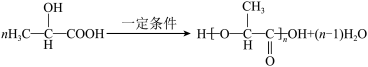 |
您最近一年使用:0次
5 . 亚硝酸钠 是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是
是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是
 是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是
是工业用盐,具有着色、增色、抑菌、防腐等作用。实验室将一定量已知的高锰酸钾标准液放入锥形瓶中再加入硫酸,用亚硝酸钠滴定高锰酸钾标准液,进行样品中亚硝酸钠的含量分析。下列有关说法错误的是A.滴定前滴定管尖嘴处有气泡,滴定后无气泡会使测得的 含量偏高 含量偏高 |
B.亚硝酸根( )空间结构为V形 )空间结构为V形 |
| C.酸性高锰酸钾溶液可以鉴别食盐和亚硝酸钠 |
D.滴定过程离子反应为: |
您最近一年使用:0次
解题方法
6 . 硒是人体不可缺少的微量元素,硒的应用范围非常广泛。以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、 、CuO、ZnO、
、CuO、ZnO、 等)提取硒一种工艺流程如下:
等)提取硒一种工艺流程如下:
(1)“脱硫”时,脱硫率随温度的变化如图所示,试分析随温度的升高,脱硫率呈上升趋势的原因;_______ ,最佳脱硫温度为_______ 。 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)“控电位还原”,是将电位高的物质先还原,电位低的物质保留在溶液中,以达到物质的分离。可采用硫脲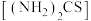 联合亚硫酸钠进行“控电位还原”,下表是“氧化酸浸”液中主要粒子的电位。
联合亚硫酸钠进行“控电位还原”,下表是“氧化酸浸”液中主要粒子的电位。
控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原 ,该过程的还原反应(半反应)式为
,该过程的还原反应(半反应)式为_______ ,为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_______ V以上。
(4)“精制”过程中 先将Se浸出转化成硒代硫酸钠(
先将Se浸出转化成硒代硫酸钠(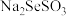 ),
),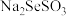 再被
再被 酸化生成硒的离子方程式为
酸化生成硒的离子方程式为_______ 。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg⋅g ,则精硒中铁的质量分数为
,则精硒中铁的质量分数为_______ %。
 、CuO、ZnO、
、CuO、ZnO、 等)提取硒一种工艺流程如下:
等)提取硒一种工艺流程如下: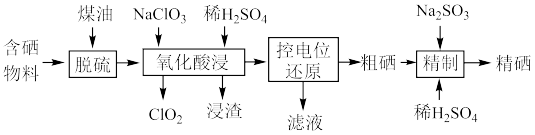
(1)“脱硫”时,脱硫率随温度的变化如图所示,试分析随温度的升高,脱硫率呈上升趋势的原因;
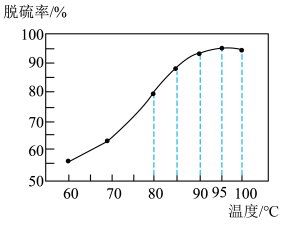
 ,该反应的化学方程式为
,该反应的化学方程式为(3)“控电位还原”,是将电位高的物质先还原,电位低的物质保留在溶液中,以达到物质的分离。可采用硫脲
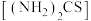 联合亚硫酸钠进行“控电位还原”,下表是“氧化酸浸”液中主要粒子的电位。
联合亚硫酸钠进行“控电位还原”,下表是“氧化酸浸”液中主要粒子的电位。名称 |
|
|
|
|
|
|
中位/V | 0.345 | -0.760 | -0.440 | 0.770 | 1.511 | 0.740 |
 ,该过程的还原反应(半反应)式为
,该过程的还原反应(半反应)式为(4)“精制”过程中
 先将Se浸出转化成硒代硫酸钠(
先将Se浸出转化成硒代硫酸钠(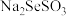 ),
),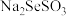 再被
再被 酸化生成硒的离子方程式为
酸化生成硒的离子方程式为(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg⋅g
 ,则精硒中铁的质量分数为
,则精硒中铁的质量分数为
您最近一年使用:0次
7 . 焦锑酸钠 可用于制作电视机显像管玻壳、纺织品阻燃剂和搪瓷乳白剂。以某含锑净渣(主要成分是SbOCl,还含有少量Cu、As等元素)为原料制备焦锑酸钠的工艺流程如下图所示。
可用于制作电视机显像管玻壳、纺织品阻燃剂和搪瓷乳白剂。以某含锑净渣(主要成分是SbOCl,还含有少量Cu、As等元素)为原料制备焦锑酸钠的工艺流程如下图所示。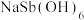 难溶于水。
难溶于水。
②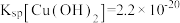 ,
, 。
。
回答下列问题:
(1)含锑净渣需进行粉碎研磨,其目的是_______ ,“浸渣”的主要成分是_______ (填“ ”或“CuS”)。
”或“CuS”)。
(2)“碱溶”时SbOCl转化为Na3SbS3,转化的化学方程式为_______ 。
(3)“氧化”时,溶液中的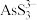 转化为易溶于水的Na3AsO4与锑分离,同时生成S,写出该反应的离子方程式
转化为易溶于水的Na3AsO4与锑分离,同时生成S,写出该反应的离子方程式_______ 。
(4)“滤液”的主要成分是_______ 。
(5)产品纯度测定:称取1.30gNaSb(OH)6样品,酸溶后加入适量硫酸肼固体配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.0500mol·L-1Ce(SO4)2标准液滴定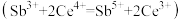 ,平均消耗标准液20.00mL。
,平均消耗标准液20.00mL。
①硫酸肼的作用是_______ 。
②产品的纯度为_______ [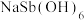 的摩尔质量为247g·mol-1]。
的摩尔质量为247g·mol-1]。
 可用于制作电视机显像管玻壳、纺织品阻燃剂和搪瓷乳白剂。以某含锑净渣(主要成分是SbOCl,还含有少量Cu、As等元素)为原料制备焦锑酸钠的工艺流程如下图所示。
可用于制作电视机显像管玻壳、纺织品阻燃剂和搪瓷乳白剂。以某含锑净渣(主要成分是SbOCl,还含有少量Cu、As等元素)为原料制备焦锑酸钠的工艺流程如下图所示。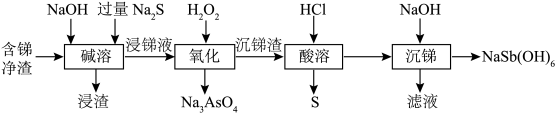
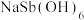 难溶于水。
难溶于水。②
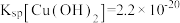 ,
, 。
。回答下列问题:
(1)含锑净渣需进行粉碎研磨,其目的是
 ”或“CuS”)。
”或“CuS”)。(2)“碱溶”时SbOCl转化为Na3SbS3,转化的化学方程式为
(3)“氧化”时,溶液中的
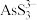 转化为易溶于水的Na3AsO4与锑分离,同时生成S,写出该反应的离子方程式
转化为易溶于水的Na3AsO4与锑分离,同时生成S,写出该反应的离子方程式(4)“滤液”的主要成分是
(5)产品纯度测定:称取1.30gNaSb(OH)6样品,酸溶后加入适量硫酸肼固体配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.0500mol·L-1Ce(SO4)2标准液滴定
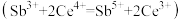 ,平均消耗标准液20.00mL。
,平均消耗标准液20.00mL。①硫酸肼的作用是
②产品的纯度为
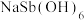 的摩尔质量为247g·mol-1]。
的摩尔质量为247g·mol-1]。
您最近一年使用:0次
名校
8 . 碘化钾用作制有机化合物及制药原料,医疗上用于防治甲状腺肿和甲状腺机能亢进的手术前准备,也可用作祛痰药。某实验室通过碘酸钾和硫化氢反应制备碘化钾。实验装置如图所示(夹持及加热装置已省略)回答下列问题:___________ ,实验中先关闭K,打开仪器___________ (填“a”、“b”或“ab”)制备碘酸钾,其反应的离子方程式为___________ 。某同学认为可以将甲装置中的 更换为粉末状
更换为粉末状 固体,你认为是否合理?
固体,你认为是否合理?___________ (填“合理”、“不合理”或“无法判断”)。
(2)乙装置中加入稀 的主要作用是
的主要作用是___________ 。
(3)如果乙装置最终生成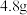 黄色沉淀,理论上可制得碘化钾的质量为
黄色沉淀,理论上可制得碘化钾的质量为___________ g。
(4)本实验尾气中的硫化氢可以用 溶液吸收,也可以用
溶液吸收,也可以用 溶液吸收。向
溶液吸收。向 溶液中通尾气直至饱和(
溶液中通尾气直至饱和( )时,溶液中刚好有
)时,溶液中刚好有 沉淀生成,此时溶液中
沉淀生成,此时溶液中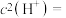
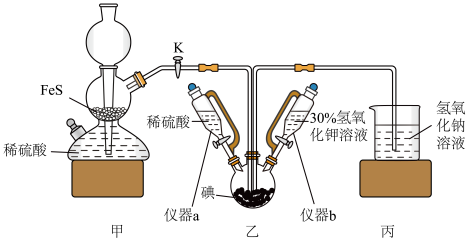
___________  (结果保留四位有效数字)。(已知
(结果保留四位有效数字)。(已知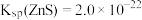 ,
, 的
的 ,
,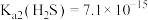 。)
。)
 更换为粉末状
更换为粉末状 固体,你认为是否合理?
固体,你认为是否合理?(2)乙装置中加入稀
 的主要作用是
的主要作用是(3)如果乙装置最终生成
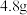 黄色沉淀,理论上可制得碘化钾的质量为
黄色沉淀,理论上可制得碘化钾的质量为(4)本实验尾气中的硫化氢可以用
 溶液吸收,也可以用
溶液吸收,也可以用 溶液吸收。向
溶液吸收。向 溶液中通尾气直至饱和(
溶液中通尾气直至饱和( )时,溶液中刚好有
)时,溶液中刚好有 沉淀生成,此时溶液中
沉淀生成,此时溶液中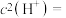
 (结果保留四位有效数字)。(已知
(结果保留四位有效数字)。(已知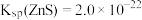 ,
, 的
的 ,
,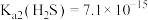 。)
。)
您最近一年使用:0次
2024-05-12更新
|
110次组卷
|
2卷引用:安徽师范大学附属中学2024届高三下学期5月测试化学试卷
解题方法
9 . A、B、C、D、E、F为短周期元素, 原子序数依次增大。非金属元素A 最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。E+与D2-具有相同的电子层结构。A单质在F单质中燃烧,产物溶于水得到一种强酸M。回答下列问题:
(1)画出E的离子结构示意图___________ 。
(2)F在周期表中的位置是___________ 。
(3)B、D、E组成的一种常见盐,其中D的质量分数约为 45%,该盐与少量M溶液反应的离子方程式为___________ 。
(4)由这些元素组成的物质,相关信息如下:
①a的电子式为___________ 。 写出其与水反应的化学方程式:___________ 。
②b的一种常见用途为___________ 。
③已知c中所有原子均满足8 电子稳定结构,该化合物的结构式为___________ 。
(1)画出E的离子结构示意图
(2)F在周期表中的位置是
(3)B、D、E组成的一种常见盐,其中D的质量分数约为 45%,该盐与少量M溶液反应的离子方程式为
(4)由这些元素组成的物质,相关信息如下:
| 物质 | 组成和结构信息 |
| a | 由 A、E组成的离子化合物 |
| b | 由D、E组成的含非极性键的离子化合物,阴阳离子数之比为1:2 |
| c | 化学式为BDF2的共价化合物 |
②b的一种常见用途为
③已知c中所有原子均满足8 电子稳定结构,该化合物的结构式为
您最近一年使用:0次
解题方法
10 . 苯胺是重要的化工原料,某化学兴趣小组在实验室里制备苯胺并提纯苯胺。
有关物质的部分物理性质如表:
I.制备苯胺
将如下图所示装置(夹持装置略,下同)置于热水浴中回流 ,使硝基苯充分还原;冷却后,往三颈烧瓶中加入
,使硝基苯充分还原;冷却后,往三颈烧瓶中加入 溶液。
溶液。 的作用是
的作用是______ ,三颈烧瓶合适的容积是______ 。
a. b.
b. c.
c.
(2)使用水浴加热的优点是______ ,三颈烧瓶中反应生成 和易溶于水的盐酸苯胺(
和易溶于水的盐酸苯胺(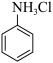 ),该反应的离子方程式为
),该反应的离子方程式为______ 。
(3)加入 的目的是
的目的是______ 。
II.提取苯胺
(4)实验步骤:
①向反应后混合物中通入热的水蒸气进行蒸馏,蒸馏时收集到苯胺与水的混合物;将此混合物分离得到粗苯胺和水溶液。
②向水溶液中加入适量乙醚萃取,然后分液得到乙醚萃取液。分液必须使用到的一种玻璃仪器名称是______ 。
③合并粗苯胺和乙醚萃取液,再加入______ 固体后再次蒸馏,得到纯苯胺 。
。
(5)该实验中苯胺的产率为______ (保留3位小数)。
有关物质的部分物理性质如表:
物质 | 熔点 | 沸点 | 溶解性 | 密度 | 相对分子质量 |
苯胺 |
| 184 | 微溶于水,易溶于乙醚 | 1.02 | 93 |
硝基苯 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 | 123 |
乙醚 |
| 34.6 | 微溶于水 | 0.7134 |
将如下图所示装置(夹持装置略,下同)置于热水浴中回流
 ,使硝基苯充分还原;冷却后,往三颈烧瓶中加入
,使硝基苯充分还原;冷却后,往三颈烧瓶中加入 溶液。
溶液。
 的作用是
的作用是a.
 b.
b. c.
c.
(2)使用水浴加热的优点是
 和易溶于水的盐酸苯胺(
和易溶于水的盐酸苯胺( ),该反应的离子方程式为
),该反应的离子方程式为(3)加入
 的目的是
的目的是II.提取苯胺
(4)实验步骤:
①向反应后混合物中通入热的水蒸气进行蒸馏,蒸馏时收集到苯胺与水的混合物;将此混合物分离得到粗苯胺和水溶液。
②向水溶液中加入适量乙醚萃取,然后分液得到乙醚萃取液。分液必须使用到的一种玻璃仪器名称是
③合并粗苯胺和乙醚萃取液,再加入
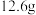 。
。(5)该实验中苯胺的产率为
您最近一年使用:0次

 /Cu
/Cu /Zn
/Zn /Fe
/Fe