1 . 金属铝质轻且具有良好的抗腐蚀性,在日常生活与工业生产中有非常重要的作用。请回答下列问题:
(1)31号元素镓(Ga)与铝同主族。镓的原子结构示意图为___________ ,写出金属镓与盐酸反应的化学方程式:___________ 。铍的单质、化合物与铝的单质、化合物分别具有相似的化学性质,写出 溶液与过量NaOH溶液反应的离子方程式:
溶液与过量NaOH溶液反应的离子方程式:___________ 。
(2)人类最早使用的金属材料的主要成分是铜。下列说法中正确的是___________(填字母)。
(3)向稀 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为(用化学式表示)
恰好完全沉淀,此时铝元素的存在形式主要为(用化学式表示)___________ 。
(4)某同学对铝与 发生铝热反应的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。
发生铝热反应的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。
①上述置换反应的化学方程式为___________ 。
②该同学推测铝热反应得到的熔融物中还含有 ,他设计了如下方案来验证:取一块该熔融物,冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含
,他设计了如下方案来验证:取一块该熔融物,冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含 。该同学的实验方案是否合理?
。该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由是___________ 。
(1)31号元素镓(Ga)与铝同主族。镓的原子结构示意图为
 溶液与过量NaOH溶液反应的离子方程式:
溶液与过量NaOH溶液反应的离子方程式:(2)人类最早使用的金属材料的主要成分是铜。下列说法中正确的是___________(填字母)。
| A.青铜和黄铜均是合金 | B.铜表面易形成致密的氧化膜 |
C.铜绿[ ]属于碱式盐 ]属于碱式盐 | D.金属铜能与 溶液发生置换反应 溶液发生置换反应 |
 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为(用化学式表示)
恰好完全沉淀,此时铝元素的存在形式主要为(用化学式表示)(4)某同学对铝与
 发生铝热反应的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。
发生铝热反应的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。①上述置换反应的化学方程式为
②该同学推测铝热反应得到的熔融物中还含有
 ,他设计了如下方案来验证:取一块该熔融物,冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含
,他设计了如下方案来验证:取一块该熔融物,冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含 。该同学的实验方案是否合理?
。该同学的实验方案是否合理?
您最近一年使用:0次
2 . 铝及其合金是生产生活中常用的一种金属材料。
(1)铝合金用于加工门窗,是因为其硬度比纯金属___________ (填“大”或“小”)。
(2)生活中不宜用铝制品盛装碱性溶液,某同学在实验中模拟该过程,将一块铝箔投入过量 溶液中,观察到的实验现象为:
溶液中,观察到的实验现象为:___________ ,其中涉及到的离子方程式为:___________ 、___________ 。
(3)工业上常利用金属Al与 在高温下反应冶炼金属Fe,该反应的化学方程式为
在高温下反应冶炼金属Fe,该反应的化学方程式为___________ ,将可以恰好完全发生该反应的Al与 均匀混合,分成两等份,一份先完全发生该反应,反应产物再与足量盐酸反应,另一份直接与足量
均匀混合,分成两等份,一份先完全发生该反应,反应产物再与足量盐酸反应,另一份直接与足量 溶液反应,生成气体在相同条件下体积比为
溶液反应,生成气体在相同条件下体积比为___________ 。
(1)铝合金用于加工门窗,是因为其硬度比纯金属
(2)生活中不宜用铝制品盛装碱性溶液,某同学在实验中模拟该过程,将一块铝箔投入过量
 溶液中,观察到的实验现象为:
溶液中,观察到的实验现象为:(3)工业上常利用金属Al与
 在高温下反应冶炼金属Fe,该反应的化学方程式为
在高温下反应冶炼金属Fe,该反应的化学方程式为 均匀混合,分成两等份,一份先完全发生该反应,反应产物再与足量盐酸反应,另一份直接与足量
均匀混合,分成两等份,一份先完全发生该反应,反应产物再与足量盐酸反应,另一份直接与足量 溶液反应,生成气体在相同条件下体积比为
溶液反应,生成气体在相同条件下体积比为
您最近一年使用:0次
名校
解题方法
3 . 按要求完成下列填空:
(1)高温下铝粉与 的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢的焊接在一起。该反应的化学方程式为
的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢的焊接在一起。该反应的化学方程式为___________ 其中被氧化的物质是___________ 。
(2)覆铜板制作印刷电路板原理的离子方程式为___________ 。
(3)先有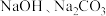 和
和 三种无色溶液,可选用一种试剂便能把它们鉴别出来,该试剂为
三种无色溶液,可选用一种试剂便能把它们鉴别出来,该试剂为___________ ,其中与 反应的离子方程式为
反应的离子方程式为___________ 。
(4)在常温下,将 通入
通入 溶液中,可以得到一种漂白液。上述反应的化学方程式为
溶液中,可以得到一种漂白液。上述反应的化学方程式为___________ 。
(5)把 镁铝合金的粉末放入过量的硫酸中,得到
镁铝合金的粉末放入过量的硫酸中,得到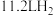 (标准状况)。镁和铝的物质的量之比为
(标准状况)。镁和铝的物质的量之比为___________ 。
(1)高温下铝粉与
 的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢的焊接在一起。该反应的化学方程式为
的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢的焊接在一起。该反应的化学方程式为(2)覆铜板制作印刷电路板原理的离子方程式为
(3)先有
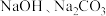 和
和 三种无色溶液,可选用一种试剂便能把它们鉴别出来,该试剂为
三种无色溶液,可选用一种试剂便能把它们鉴别出来,该试剂为 反应的离子方程式为
反应的离子方程式为(4)在常温下,将
 通入
通入 溶液中,可以得到一种漂白液。上述反应的化学方程式为
溶液中,可以得到一种漂白液。上述反应的化学方程式为(5)把
 镁铝合金的粉末放入过量的硫酸中,得到
镁铝合金的粉末放入过量的硫酸中,得到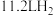 (标准状况)。镁和铝的物质的量之比为
(标准状况)。镁和铝的物质的量之比为
您最近一年使用:0次
2024-02-24更新
|
52次组卷
|
2卷引用:云南省昭通市第一中学教研联盟2023-2024学年高一上学期期末质量检测化学(B卷)试题
2024高三·全国·专题练习
解题方法
4 . 下列关于金属铝的叙述中,不正确的是_______ 。
A.铝的化学性质很活泼,但在空气中不易锈蚀
B.铝箔在空气中受热可以熔化,且发生剧烈燃烧
C.铝是比较活泼的金属,常温下能与盐酸、NaOH溶液等发生反应
D.相同质量的铝分别与足量的盐酸和氢氧化钠反应,产生氢气的量相同
E.铝能与氧化镁在高温下发生铝热反应,制备金属镁
F.铝能与氧化铁在高温下发生铝热反应,制备金属铁
G.将铝箔放在酒精灯上加热,有熔融的铝液滴下
H.将铝箔表面打磨后,立即放在酒精灯上加热,有熔融的铝液滴下
A.铝的化学性质很活泼,但在空气中不易锈蚀
B.铝箔在空气中受热可以熔化,且发生剧烈燃烧
C.铝是比较活泼的金属,常温下能与盐酸、NaOH溶液等发生反应
D.相同质量的铝分别与足量的盐酸和氢氧化钠反应,产生氢气的量相同
E.铝能与氧化镁在高温下发生铝热反应,制备金属镁
F.铝能与氧化铁在高温下发生铝热反应,制备金属铁
G.将铝箔放在酒精灯上加热,有熔融的铝液滴下
H.将铝箔表面打磨后,立即放在酒精灯上加热,有熔融的铝液滴下
您最近一年使用:0次
名校
5 . 物质集合 中含有常见物质
中含有常见物质 、
、 、
、 、
、 、
、 、
、 、
、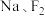 。这些物质按照以下方法进行分类后如图所示,请按照要求回答问题。
。这些物质按照以下方法进行分类后如图所示,请按照要求回答问题。
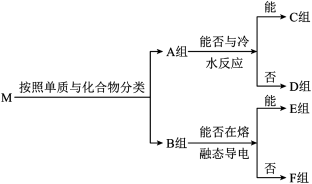
(1)B组物质中属于非电解质的为___________ 。
(2)C组物质中能与水反应生成还原性气体的化学方程式为___________ 。
(3)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:___________ 。
(4)请写出 组中的酸性氧化物与酸性
组中的酸性氧化物与酸性 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
(5)在密闭容器中,将 组中的两种物质充分加热后排出气体,经测定,所得固体为纯净物,该纯净物的化学式为
组中的两种物质充分加热后排出气体,经测定,所得固体为纯净物,该纯净物的化学式为___________ 。
 中含有常见物质
中含有常见物质 、
、 、
、 、
、 、
、 、
、 、
、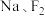 。这些物质按照以下方法进行分类后如图所示,请按照要求回答问题。
。这些物质按照以下方法进行分类后如图所示,请按照要求回答问题。
(1)B组物质中属于非电解质的为
(2)C组物质中能与水反应生成还原性气体的化学方程式为
(3)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:
(4)请写出
 组中的酸性氧化物与酸性
组中的酸性氧化物与酸性 溶液反应的离子方程式:
溶液反应的离子方程式:(5)在密闭容器中,将
 组中的两种物质充分加热后排出气体,经测定,所得固体为纯净物,该纯净物的化学式为
组中的两种物质充分加热后排出气体,经测定,所得固体为纯净物,该纯净物的化学式为
您最近一年使用:0次
6 . Ⅰ.钠、铝、铁是三种重要的金属,它们的单质及其化合物在生活生产中有重要的作用。请回答下列问题:
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:_______ ,该反应中氧化剂和还原剂的物质的量之比为______ 。
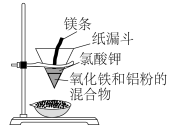
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是: 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ (填化学式),该试剂与金属铝反应的离子方程式为_______ 。
(3)另一同学推测铝热反应得到的熔融物中还含有 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是_______ (填化学式)。该同学的实验方案是否合理?______ (填“合理”或“不合理”)。理由:_______ (用离子方程式说明)。
(1)钠着火不能用二氧化碳来灭火,已知钠在足量二氧化碳中燃烧生成炭黑和一种白色固体。根据实验现象写出方程式:
Ⅱ.一些活泼金属也可作还原剂,将相对不活泼的金属从其化合物中置换出来。例如“铝热反应”的原理是:
 。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
。其反应装置如下图所示,已知镁条与氯酸钾反应产生高温可引发“铝热反应”。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入装有沙子的蒸发皿中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
| 物质 | Al |  | Fe |  |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
(2)该同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)另一同学推测铝热反应得到的熔融物中还含有
 ,他设计了如下方案来验证熔融物是否有
,他设计了如下方案来验证熔融物是否有 剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有
剩余:取一块该熔融物冷却后投入到稍过量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有 。则物质甲是
。则物质甲是
您最近一年使用:0次
2024-01-14更新
|
172次组卷
|
2卷引用:辽宁省部分高中2023-2024学年高一上学期期末考试高化学试题
7 . 写出下列反应的化学方程式或离子方程式。
(1)小苏打受热分解的化学方程式:____________ 。
(2)工业合成氨的化学方程式:___________ 。
(3)红热的铁与水蒸气反应的化学方程式:___________ 。
(4)用于野外焊接铁轨的铝热反应的化学方程式:_____________ 。
(5)氯化铁溶液与KI溶液反应的离子方程式:___________ 。
(6)红热的木炭与浓硫酸反应的化学方程式:___________ 。
(1)小苏打受热分解的化学方程式:
(2)工业合成氨的化学方程式:
(3)红热的铁与水蒸气反应的化学方程式:
(4)用于野外焊接铁轨的铝热反应的化学方程式:
(5)氯化铁溶液与KI溶液反应的离子方程式:
(6)红热的木炭与浓硫酸反应的化学方程式:
您最近一年使用:0次
8 . 下列有关金属冶炼的说法不正确的是_______ 。
A.可以用电解熔融氯化钠的方法来制取金属钠
B.银可以采用热分解法,即通过加热Ag2O制得
C.用电解法冶炼铝时,原料是氯化铝
D.高炉炼铁中利用焦炭直接将铁矿石还原为铁单质
E.工业上可以用铝热反应来冶炼某些熔点较高的金属,如铬、锰
F.用铝与氧化镁的混合物作铝热剂冶炼镁
G.以铝土矿为原料获得氧化铝固体,电解熔融的氧化铝得到铝
H.利用焦炭与氧气反应生成的CO在高温下还原铁矿石得到铁
A.可以用电解熔融氯化钠的方法来制取金属钠
B.银可以采用热分解法,即通过加热Ag2O制得
C.用电解法冶炼铝时,原料是氯化铝
D.高炉炼铁中利用焦炭直接将铁矿石还原为铁单质
E.工业上可以用铝热反应来冶炼某些熔点较高的金属,如铬、锰
F.用铝与氧化镁的混合物作铝热剂冶炼镁
G.以铝土矿为原料获得氧化铝固体,电解熔融的氧化铝得到铝
H.利用焦炭与氧气反应生成的CO在高温下还原铁矿石得到铁
您最近一年使用:0次
名校
9 . 填空。
(1)欲除去FeCl2溶液中的Fe3+,可向溶液中加少量___________ ,请用离子方程式表示除杂原理___________ 。
(2)下列属于氮的固定的是___________ (填序号)。
①工业合成氨
②雷雨天气N2与O2反应
③工业制硝酸的第一步反应:氨的催化氧化
写出上述反应①③的化学方程式:①___________ ,③___________ 。
(3)Fe2O3和铝粉常用于野外焊接钢轨,试写出其化学方程式:___________ 。
(4)检验 的离子方程式:
的离子方程式:___________ 。
(1)欲除去FeCl2溶液中的Fe3+,可向溶液中加少量
(2)下列属于氮的固定的是
①工业合成氨
②雷雨天气N2与O2反应
③工业制硝酸的第一步反应:氨的催化氧化
写出上述反应①③的化学方程式:①
(3)Fe2O3和铝粉常用于野外焊接钢轨,试写出其化学方程式:
(4)检验
 的离子方程式:
的离子方程式:
您最近一年使用:0次
名校
解题方法
10 . 以下是有关铝的实验探究,请回答相关问题:
(1)用铝粉和 Fe2O3做铝热反应实验,需要的试剂还有___________。
(2)镁能发生和铝类似的“镁热反应”,写出镁在高温下和 Fe2O3反应的化学方程式___________ 。
(3)向集满CO2的铝制易拉罐中加入过量 NaOH 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪; 再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:___________ 。
(4)向铝粉中添加少量 NH4Cl固体并充分混合,将其加热到1000℃时可与 N₂反应制备 AlN,下列说法正确的是___________
(5)用打磨过的铝片进行如下实验, 下列分析不合理的是___________
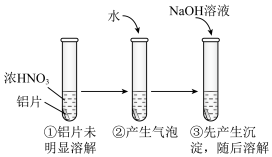
(6)为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
下列说法不正确的是___________
(7)某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和 SiO2杂质。称取 17.50g铝土矿样品,加入 200mL1.65mol/L 的稀硫酸,恰好完全反应,过滤得沉淀0.30g,然后在滤液中加入足量的 NaOH 溶液,得到沉淀 2.14g。
①该试样中Fe2O3的物质的量为___________ mol。
② 样品中Al2O3·xH2O的x=__________ 。
(1)用铝粉和 Fe2O3做铝热反应实验,需要的试剂还有___________。
| A.KCl | B.KClO3 | C.MnO2 | D.Mg |
(2)镁能发生和铝类似的“镁热反应”,写出镁在高温下和 Fe2O3反应的化学方程式
(3)向集满CO2的铝制易拉罐中加入过量 NaOH 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪; 再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:
(4)向铝粉中添加少量 NH4Cl固体并充分混合,将其加热到1000℃时可与 N₂反应制备 AlN,下列说法正确的是___________
| A.AlN是一种金属材料 |
| B.AlN与足量氢氧化钠溶液共热时生成氢氧化铝和氨气 |
| C.少量 NH4Cl能够破坏 Al表面的 Al2O3薄膜 |
| D.AlN与足量盐酸反应的离子方程式为AlN+3H+=Al3++NH3↑ |
(5)用打磨过的铝片进行如下实验, 下列分析不合理的是___________

| A.①中铝片发生了钝化 |
| B.②中产生的气泡是氮氧化合物,不是氢气 |
| C.③中沉淀溶解的离子方程式是Al(OH)3+OH-=[Al(OH)4]- |
| D.②中加水稀释过程中,仅发生了氧化还原反应 |
(6)为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
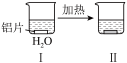 |  | |
| 无明显现象 | 铝片表面产生细小气泡 | 出现白色沉淀,产生大量气泡(经检验为H2和CO2) |
A.Na2CO3溶液中存在水解平衡: 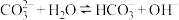 |
| B.对比Ⅰ 、Ⅲ,推测 Na2CO3溶液能破坏铝表面的氧化膜 |
| C.Ⅳ溶液中可能存在大量 Al3+ |
D.推测出现白色浑浊的可能原因:[Al(OH)4]-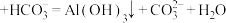 |
(7)某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和 SiO2杂质。称取 17.50g铝土矿样品,加入 200mL1.65mol/L 的稀硫酸,恰好完全反应,过滤得沉淀0.30g,然后在滤液中加入足量的 NaOH 溶液,得到沉淀 2.14g。
①该试样中Fe2O3的物质的量为
② 样品中Al2O3·xH2O的x=
您最近一年使用:0次



