已知A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大.B和E同主族,A、B在元素周期表中处于相邻的位置,C元素原子在同周期主族元素中原子半径最大,D是地壳中含量最多的金属元素,E元素原子的最外层电子数是电子层数的2倍.请回答下列问题:
(1)画出F的原子结构示意图_____ 。
(2)B、C、E对应简单离子的半径由大到小的顺序为_____ (用具体微粒符号表示)。
(3)A的气态氢化物与其最高价氧化物对应水化物反应,生成的化合物属于_____ (填“离子化合物”或“共价化合物”)。
(4)加热条件下,B单质与C单质的反应产物的电子式为______ 。
(5)D元素最高价氧化物对应水化物与C元素最高价氧化物对应水化物的溶液反应的化学方程式为______ 。
(1)画出F的原子结构示意图
(2)B、C、E对应简单离子的半径由大到小的顺序为
(3)A的气态氢化物与其最高价氧化物对应水化物反应,生成的化合物属于
(4)加热条件下,B单质与C单质的反应产物的电子式为
(5)D元素最高价氧化物对应水化物与C元素最高价氧化物对应水化物的溶液反应的化学方程式为
更新时间:2020-05-14 15:37:35
|
【知识点】 元素周期律、元素周期表的推断
相似题推荐
填空题
|
适中
(0.65)
【推荐1】稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。
我国蕴藏着丰富的钇矿石( Y2 FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:

已知:
I.有关金属离子形成氢氧化物沉淀时的pH如下表:
Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为__________ 。
(2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸、_____ (填字母代号)两种试剂,再通过必要的实验操作方可实现。
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:_______________ :必要的实验操作应是________________ 。
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在______ 的范围内;继续加氨
水调节pH =b发生反应的离子方程式为_______________ ,溶液中Fe3+完全沉淀的判定标准是__________________ 。
(4)写出草酸钇[Y2(C2O4)3.Nh2O]煅烧的化学方程式______________ 。
我国蕴藏着丰富的钇矿石( Y2 FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:

已知:
I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为
(2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸、
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在
水调节pH =b发生反应的离子方程式为
(4)写出草酸钇[Y2(C2O4)3.Nh2O]煅烧的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】有A、B、C、D四种元素,A元素的原子得2个电子,B元素的原子失去1个电子后所形成的微粒为氩原子有相同的电子层结构。C元素的原子只有1个电子,D元素原子的M电子层电子数比N层电子数多6个。试写出:
(1)A、B、C、D的元素名称:A____ 、B____ 、C____ 、D____ 。
(2)画出A元素的原子结构示意图_______ ,D元素的离子结构示意图_______ 。
(3)画出A离子的电子式_______ ,B原子的电子式_______ 。
(1)A、B、C、D的元素名称:A
(2)画出A元素的原子结构示意图
(3)画出A离子的电子式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】核外电子排布与化学键。在含有多个电子的原子例,电子的能量不同,根据电子能量的差异,电子应先排布在能量最低的电子层例,然后再依次由里向外排布在能量逐渐升高的电子层例,即分层排布。亨利·莫斯莱和查尔斯·巴克拉的X-射线吸收研究首次与实验中发现电子层。巴克拉把他们称为K、L、M、N(以英文字母排列)等电子层,这些字母后来被n值1、2、3等取代。
(1)结构示意图可以简明地表示微粒的核外电子排布,是一种用于表示原子或离子整体结构的图示。电子式是一类反应原子最外层电子情况,以及微粒之间化学键种类的化学语言。下列表示式正确的是___________
(2)在1916年,G.N。Lewis在讲述他的化学键理论时提出了电子式,故电子式又被称为路易斯式。根据经典的共价键理论,在形成化合物时,原子核外的单电子要尽可能地进行配对,并达到8电子稳定结构(H为2电子稳定结构)。写出 的电子式:
的电子式:___________ 。
(3)在元素周期表中,原子按核电荷数和原子核外电子排布的周期性变化进行排列。一些元素的原子易失去电子或得到电子形成离子,使最外层达到稳定结构。

如表所示是元素周期表的一部分,A、B、C均为短周期元素。已知B、C原子核外电子数之和是A原子核外电子数的4倍,则以下叙述中正确的是___________
(4)化学键(chemical bond)是纯净物分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用力的统称。常见的化学键有离子键和共价键。离子键是由正离子和负离子之间相互的静电作用力形成的。共价键是由两个或多个原子共同使用他们的外层电子,在理想的情况下达到电子饱和状态,由此组成比较稳定的化学结构。在下列物质中:
①Ar ②SiC ③NaCl ④ ⑤
⑤ ⑥NaOH ⑦
⑥NaOH ⑦
其中,存在离子键的物质有___________ (填编号,下同),存在共价键的物质有___________ 。
(5)一般来说,主族元素的性质会随原子序数增加而呈现的变化,称为元素周期律。元素的非金属性表现为元素原子的得电子能力,元素非金属越的强弱会影响非金属单质的氧化性、气态氢化物的稳定性等等。下列物质的性质与解释均正确,且对应关系也正确的是___________
(1)结构示意图可以简明地表示微粒的核外电子排布,是一种用于表示原子或离子整体结构的图示。电子式是一类反应原子最外层电子情况,以及微粒之间化学键种类的化学语言。下列表示式正确的是
A.硫离子的结构示意图: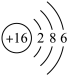 | B.钾原子的结构示意图: |
C.氯离子的电子式: | D.镁离子的电子式: |
 的电子式:
的电子式:(3)在元素周期表中,原子按核电荷数和原子核外电子排布的周期性变化进行排列。一些元素的原子易失去电子或得到电子形成离子,使最外层达到稳定结构。

如表所示是元素周期表的一部分,A、B、C均为短周期元素。已知B、C原子核外电子数之和是A原子核外电子数的4倍,则以下叙述中正确的是
| A.A、B、C都是非金属元素 | B.A、B、C最高价氧化物的水化物均为强酸 |
| C.A、B、C三种核电荷数之和是39 | D.B与A、C均能形成离子化合物 |
①Ar ②SiC ③NaCl ④
 ⑤
⑤ ⑥NaOH ⑦
⑥NaOH ⑦
其中,存在离子键的物质有
(5)一般来说,主族元素的性质会随原子序数增加而呈现的变化,称为元素周期律。元素的非金属性表现为元素原子的得电子能力,元素非金属越的强弱会影响非金属单质的氧化性、气态氢化物的稳定性等等。下列物质的性质与解释均正确,且对应关系也正确的是
| 选项 | 性质 | 解释 |
| A | 还原性: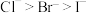 | Cl、Br、I的非金属性依次减弱 |
| B | 沸点: | N的非金属性比P强 |
| C | 分解温度: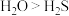 | O的非金属性比S强 |
| D | 酸性: | Cl的非金属比S强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



