I.由三种元素组成的难溶化合物 是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究
是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究 的组成(已知
的组成(已知 与稀盐酸恰好完全反应,且溶液
与稀盐酸恰好完全反应,且溶液 与
与 溶液作用显血红色)。
溶液作用显血红色)。
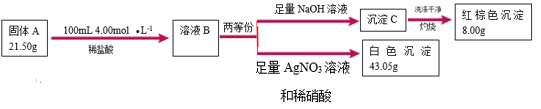
(1) 中非金属元素是
中非金属元素是________ , 的化学式是
的化学式是________ 。
(2)固体 与稀盐酸反应的离子方程式是
与稀盐酸反应的离子方程式是________ 。
(3) 、化合物
、化合物 、有机溶剂(可传导
、有机溶剂(可传导 )组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为
)组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为________ 。
Ⅱ.草酸亚铁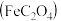 是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性
是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性 溶液,发现
溶液,发现 溶液褪色,说明样品中有二价铁。
溶液褪色,说明样品中有二价铁。
(1)上述实验方案是否科学?说明理由________ 。
(2)请提出改进的实验方案________ 。
 是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究
是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究 的组成(已知
的组成(已知 与稀盐酸恰好完全反应,且溶液
与稀盐酸恰好完全反应,且溶液 与
与 溶液作用显血红色)。
溶液作用显血红色)。 
(1)
 中非金属元素是
中非金属元素是 的化学式是
的化学式是(2)固体
 与稀盐酸反应的离子方程式是
与稀盐酸反应的离子方程式是(3)
 、化合物
、化合物 、有机溶剂(可传导
、有机溶剂(可传导 )组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为
)组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为Ⅱ.草酸亚铁
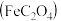 是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性
是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性 溶液,发现
溶液,发现 溶液褪色,说明样品中有二价铁。
溶液褪色,说明样品中有二价铁。(1)上述实验方案是否科学?说明理由
(2)请提出改进的实验方案
更新时间:2020-10-15 10:10:51
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】有一无色透明溶液200mL,欲确定是否含有下列离子: 、
、 、
、 、
、 、
、 、
、 、
、 ,
, 、
、 、
、 、
、 、
、 。分成四等份,取一份溶液进行如下实验:
。分成四等份,取一份溶液进行如下实验:
①加几滴甲基橙溶液变红色;
②加入足量 溶液,生成白色沉淀和溶液A;在溶液A中加
溶液,生成白色沉淀和溶液A;在溶液A中加 溶液有稳定的白色沉淀生成,且不溶于稀硝酸;
溶液有稳定的白色沉淀生成,且不溶于稀硝酸;
③加热浓缩,加入Cu片和稀盐酸,有无色气体产生,气体遇空气变成红棕色,溶液中阴离子种类不变;
④加入足量NaOH溶液,生成白色沉淀和溶液B,溶液B中通入过量 ,加热、过滤、洗涤、灼烧,得到白色沉淀(1.02g)。
,加热、过滤、洗涤、灼烧,得到白色沉淀(1.02g)。
回答下列问题:
(1)溶液中肯定存在的阴离子是_______ 。
(2)如何实验检验其中的 ,
,_______ ,说明 存在。
存在。
(3)为了进一步确定其它离子,应该补充的实验为(不必写详细操作步骤)_______ 。
(4)步骤④中“加入足量NaOH溶液”,共有_______ 种阳离子发生反应。
(5)原溶液中
_______  。
。
(6)步骤④中加热的目的是_______ 。
 、
、 、
、 、
、 、
、 、
、 、
、 ,
, 、
、 、
、 、
、 、
、 。分成四等份,取一份溶液进行如下实验:
。分成四等份,取一份溶液进行如下实验:①加几滴甲基橙溶液变红色;
②加入足量
 溶液,生成白色沉淀和溶液A;在溶液A中加
溶液,生成白色沉淀和溶液A;在溶液A中加 溶液有稳定的白色沉淀生成,且不溶于稀硝酸;
溶液有稳定的白色沉淀生成,且不溶于稀硝酸;③加热浓缩,加入Cu片和稀盐酸,有无色气体产生,气体遇空气变成红棕色,溶液中阴离子种类不变;
④加入足量NaOH溶液,生成白色沉淀和溶液B,溶液B中通入过量
 ,加热、过滤、洗涤、灼烧,得到白色沉淀(1.02g)。
,加热、过滤、洗涤、灼烧,得到白色沉淀(1.02g)。回答下列问题:
(1)溶液中肯定存在的阴离子是
(2)如何实验检验其中的
 ,
, 存在。
存在。(3)为了进一步确定其它离子,应该补充的实验为(不必写详细操作步骤)
(4)步骤④中“加入足量NaOH溶液”,共有
(5)原溶液中

 。
。(6)步骤④中加热的目的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】Ⅰ.写出下列反应的离子方程式:
(1)将鸡蛋壳在醋酸中溶解有气泡产生:_____________________________________________ ;
(2)CuSO4溶液与Ba(OH)2溶液混合:________________________________________ 。
Ⅱ.对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有 、Na+、
、Na+、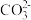 、H+、
、H+、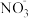 、
、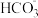 、Cl−等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
、Cl−等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
①用石蕊试液检测该溶液时,溶液显红色。
②取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是__________ ,一定不存在的离子是____________ 。
(2)在上述实验操作中,有错误的步骤是(填代号)______ 。对该错误改正的方法是(要作较详细的说明)_________________________________________________________ 。
(3)到目前为止,不能肯定在原溶液中是否存在的离子是____________ 。
(1)将鸡蛋壳在醋酸中溶解有气泡产生:
(2)CuSO4溶液与Ba(OH)2溶液混合:
Ⅱ.对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有
 、Na+、
、Na+、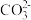 、H+、
、H+、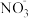 、
、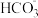 、Cl−等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
、Cl−等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。①用石蕊试液检测该溶液时,溶液显红色。
②取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是
(2)在上述实验操作中,有错误的步骤是(填代号)
(3)到目前为止,不能肯定在原溶液中是否存在的离子是
您最近一年使用:0次
【推荐3】某兴趣小组制备氢氧化亚铁沉淀。
(1)实验1中产生白色沉淀的离子方程式是_______ 。
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3,方案是______ 。
②乙同学查阅文献:Fe(OH)2在大量SO42-存在的情况下形成Fe6(SO4)2(OH)4O3(一种灰绿色氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入________ ,再往试管中加入_________ ,振荡,现象与实验1相同,结论是该假设不成立。
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
该实验得出的结论是________ 。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是__________ ,证明该假设成立。
(3)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件_____ 。
(4)下列情况会导致所配NaOH溶液的浓度偏高的是_______ 。
A.NaOH溶液未冷却至室温就进行定容 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
| 实验1 |  | 实验现象 |
| 液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
(1)实验1中产生白色沉淀的离子方程式是
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3,方案是
②乙同学查阅文献:Fe(OH)2在大量SO42-存在的情况下形成Fe6(SO4)2(OH)4O3(一种灰绿色氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
| 试管中10mLNaOH溶液 | 滴加FeSO4溶液 | 实验现象 | |
| 实验2 | 6 mol/LNaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
| 实验3 | 6 mol/LNaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是
(3)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件
(4)下列情况会导致所配NaOH溶液的浓度偏高的是
A.NaOH溶液未冷却至室温就进行定容 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂,已知高铁酸钾可溶于水、微溶于浓碱,在低温下、强碱溶液中比较稳定。工业上常采用反应:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O制备高铁酸钾,某小组同学在实验室中模拟工业进行制备,实验装置如下。请回答下列问题:

(1)蒸馏烧瓶中发生反应的离子方程式为_______ 。
(2)装置B中盛放的药品为_______ 。
(3)制备的K2FeO4粗产品中含有Fe(OH)3、KCl等杂质,其提纯方法为:①将粗产品溶于冷的稀KOH溶液,②过滤,③向滤液中加入冷的浓KOH溶液,④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤最后在真空干燥箱中干燥。操作①和③中的KOH溶液能否互换,并说明理由_______ ;用乙醇洗涤而不用水洗涤的优点是_______ 。
(4)工业上常用“滴定法”测定高铁酸钾样品的纯度,其方法是:称取2.0 g K2FeO4样品溶于3 mol·L−1 KOH溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250 mL容量瓶中定容。定容后取25.00 mL加入稀硫酸酸化,用0.100 0 mol·L−1的(NH4)2Fe(SO4)2标准溶液滴定至终点,重复操作3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为20.00 mL。已知:
a. +
+ +2H2O=
+2H2O= +Fe(OH)3↓+OH−
+Fe(OH)3↓+OH−
b.2 +2H+=
+2H+= +H2O
+H2O
c. +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
①滴定时应将0.10 mol·L−1的(NH4)2Fe(SO4)2标准溶液加入_______ (填“酸式”或“碱式”)滴定管中。
②该K2FeO4样品的纯度为_______ 。
③若滴定过程中锥形瓶每次都用待测液润洗,则会使测得的样品纯度_______ (填“偏大”“偏小”或“不变”)。

(1)蒸馏烧瓶中发生反应的离子方程式为
(2)装置B中盛放的药品为
(3)制备的K2FeO4粗产品中含有Fe(OH)3、KCl等杂质,其提纯方法为:①将粗产品溶于冷的稀KOH溶液,②过滤,③向滤液中加入冷的浓KOH溶液,④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤最后在真空干燥箱中干燥。操作①和③中的KOH溶液能否互换,并说明理由
(4)工业上常用“滴定法”测定高铁酸钾样品的纯度,其方法是:称取2.0 g K2FeO4样品溶于3 mol·L−1 KOH溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250 mL容量瓶中定容。定容后取25.00 mL加入稀硫酸酸化,用0.100 0 mol·L−1的(NH4)2Fe(SO4)2标准溶液滴定至终点,重复操作3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为20.00 mL。已知:
a.
 +
+ +2H2O=
+2H2O= +Fe(OH)3↓+OH−
+Fe(OH)3↓+OH− b.2
 +2H+=
+2H+= +H2O
+H2Oc.
 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O①滴定时应将0.10 mol·L−1的(NH4)2Fe(SO4)2标准溶液加入
②该K2FeO4样品的纯度为
③若滴定过程中锥形瓶每次都用待测液润洗,则会使测得的样品纯度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某校课外实验小组同学设计如图所示装置进行实验(夹持装置已略去)。

(1)该小组同学用如图装置进行“乙炔的制取及性质验证”实验。
①制取乙炔的化学方程式是_____ 。
②打开开关b将乙炔由c处导出,先通入_____ 溶液中除杂,后通入KMnO4酸性溶液,观察到的现象是_____ ,乙炔发生了_____ 反应;将除杂后的乙炔通入溴的CCl4溶液中观察到现象是_____ ,乙炔发生了_____ 反应。
③为安全起见,点燃乙炔前应_____ ;在导管口c处点燃乙炔,观察到的现象是_____ 。
(2)该小组同学用上图装置进行实验,确定某饱和醇的结构。
①反应前,先对量气管进行第一次读数。反应后,待装置温度冷却到室温,再对量气管进行第二次读数。读数时,应注意的操作是:_____ ,并使视线与凹液面最低处相平。
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
已知该饱和醇的相对分子质量为62,由上述数据推知该醇的结构简式为_____ 。

(1)该小组同学用如图装置进行“乙炔的制取及性质验证”实验。
①制取乙炔的化学方程式是
②打开开关b将乙炔由c处导出,先通入
③为安全起见,点燃乙炔前应
(2)该小组同学用上图装置进行实验,确定某饱和醇的结构。
①反应前,先对量气管进行第一次读数。反应后,待装置温度冷却到室温,再对量气管进行第二次读数。读数时,应注意的操作是:
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
| 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 | |
| ① | 0.62g | 5.0g(足量) | 40mL | 264mL |
| ② | 0.31g | 2.5g(足量) | 40mL | 152mL |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业作出了突出贡献。以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O===NH4HCO3;NH4HCO3+NaCl===NaHCO3↓+NH4Cl;2NaHCO3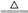 Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
【探究实例】
Ⅰ.原理分析 碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________ .
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出
Ⅱ.实验探究
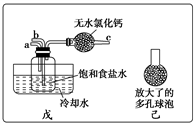
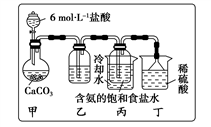
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
回答下列有关问题:
①丁装置中稀硫酸的作用是____________ ;
②实验结束后,分离出NaHCO3晶体的操作是________ (填分离操作的名称)。如何进一步提纯(写出具体的操作)_________________________________________________ 。
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。
①实验时,须先从_________ 管通入_______ 气体,再从_______ 管中通入_____________ 气体。
②有同学建议在戊装置的b导管下端连接己装置,理由是_______________ 。
 Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。【探究实例】
Ⅰ.原理分析 碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出
Ⅱ.实验探究
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。


回答下列有关问题:
①丁装置中稀硫酸的作用是
②实验结束后,分离出NaHCO3晶体的操作是
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。
①实验时,须先从
②有同学建议在戊装置的b导管下端连接己装置,理由是
您最近一年使用:0次



