蓝色钾盐水合物KaCub(C2O4)c·H2O(铜元素为+2价)的组成可通过下列实验确定:
步骤①:称取一定质量的样品置于锥形瓶中,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.0200 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00 mL( 的还原产物为Mn2+)。
的还原产物为Mn2+)。
步骤②:充分加热滴定后的溶液,冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI,发生反应2Cu2++4I-=2CuI↓+I2
步骤③:加入少量淀粉溶液作指示剂,用0.0200 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液15.00 mL,发生反应I2+2 =2I-+
=2I-+
(1)若步骤②中未对滴定后的溶液进行加热,则测出的Cu2+的物质的量将____ (填“偏大”、“偏小” 或“不变”) 。
(2)步骤③中滴定终点的现象是___________ 。
(3)通过计算确定a:b:c=___________ 。(写出计算过程)
步骤①:称取一定质量的样品置于锥形瓶中,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.0200 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00 mL(
 的还原产物为Mn2+)。
的还原产物为Mn2+)。步骤②:充分加热滴定后的溶液,冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI,发生反应2Cu2++4I-=2CuI↓+I2
步骤③:加入少量淀粉溶液作指示剂,用0.0200 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液15.00 mL,发生反应I2+2
 =2I-+
=2I-+
(1)若步骤②中未对滴定后的溶液进行加热,则测出的Cu2+的物质的量将
(2)步骤③中滴定终点的现象是
(3)通过计算确定a:b:c=
更新时间:2020-07-21 08:54:27
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】聚合硫酸铁(PFS)是水处理中重要的絮凝剂。
A.如图是以回收废铁屑为原料制备某种PFS的一种工艺流程。
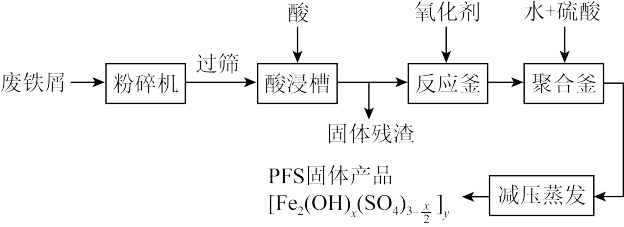
回答下列问题
(1)粉碎过筛的目的是___________ 。
(2)酸浸时最合适的酸是___________ 。
(3)若反应釜中加入氧化剂是 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
B.实验室用Cl2与KOH溶液反应制备KClO溶液,其装置如图所示。
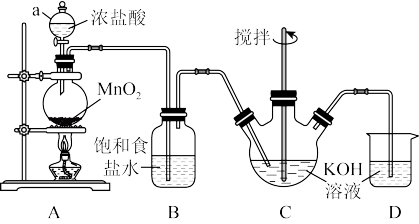
已知:C中反应是放热反应
(4)装置A中仪器a的名称是___________ ;装置B的作用是___________ 。
(5) 和KOH在较高温度下反应生成
和KOH在较高温度下反应生成 ,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是___________ (回答一点即可)。
(6)装置D发生反应的离子方程式为___________ 。
C.以KClO溶液及废铁屑等为原料,可制备高效水处理剂聚合硫酸铁[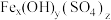 ]。聚合硫酸铁[
]。聚合硫酸铁[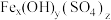 ] (其中Fe元素为+3价)的组成可通过下列实验测定:
] (其中Fe元素为+3价)的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁溶于稀盐酸中,往所得溶液中滴加 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
②另称取与①等质量的聚合硫酸铁溶于稀硫酸中,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00mL溶液B;
③准确量取25.00mL溶液B,用0.1000mol/L的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液8.00mL。该步反应为:
溶液8.00mL。该步反应为: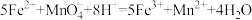 。
。
(7)通过计算确定该聚合硫酸铁的化学式(写出计算过程)___________ 。
A.如图是以回收废铁屑为原料制备某种PFS的一种工艺流程。

回答下列问题
(1)粉碎过筛的目的是
(2)酸浸时最合适的酸是
(3)若反应釜中加入氧化剂是
 ,写出该反应的离子方程式
,写出该反应的离子方程式B.实验室用Cl2与KOH溶液反应制备KClO溶液,其装置如图所示。

已知:C中反应是放热反应
(4)装置A中仪器a的名称是
(5)
 和KOH在较高温度下反应生成
和KOH在较高温度下反应生成 ,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是(6)装置D发生反应的离子方程式为
C.以KClO溶液及废铁屑等为原料,可制备高效水处理剂聚合硫酸铁[
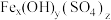 ]。聚合硫酸铁[
]。聚合硫酸铁[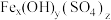 ] (其中Fe元素为+3价)的组成可通过下列实验测定:
] (其中Fe元素为+3价)的组成可通过下列实验测定:①称取一定质量的聚合硫酸铁溶于稀盐酸中,往所得溶液中滴加
 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;②另称取与①等质量的聚合硫酸铁溶于稀硫酸中,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00mL溶液B;
③准确量取25.00mL溶液B,用0.1000mol/L的
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液8.00mL。该步反应为:
溶液8.00mL。该步反应为: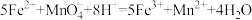 。
。(7)通过计算确定该聚合硫酸铁的化学式(写出计算过程)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】叠氮化钠(NaN3)是汽车安全气囊的主要成分,实验室制取叠氮化钠的实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
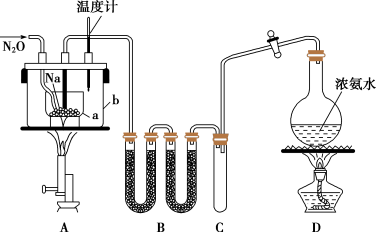
(1)装置B中盛放的药品为____ 。
(2)步骤①中先加热通氨气一段时间的目的是____ ;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为____ 。步骤③中最适宜的加热方式为___ (填“水浴加热”,“油浴加热”)。
(3)生成NaN3的化学方程式为____ 。
(4)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质均不参与反应)。
③充分反应后滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+=Ce3++Fe3+)。计算可知叠氮化钠的质量分数为____ (保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是____ (填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(5)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式____ 。
①打开装置D导管上的旋塞,加热制取氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。

(1)装置B中盛放的药品为
(2)步骤①中先加热通氨气一段时间的目的是
(3)生成NaN3的化学方程式为
(4)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质均不参与反应)。
③充分反应后滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+=Ce3++Fe3+)。计算可知叠氮化钠的质量分数为
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(5)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
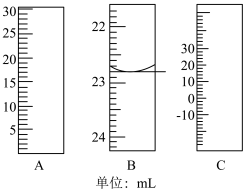
(1)如图分别是温度计、量筒、滴定管的一部分,其中A仪器的名称为________ ,B的正确读数为________ 。
(2)TiCl4水解生成TiO2•xH2O的化学方程式为______________________________ 。
(3)判断滴定终点的现象是________________________________________ 。
(4)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样wg,消耗c mol/L NH4Fe(SO4)2 标准溶液VmL,则TiO2质量分数表达式为______________________________ 。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________ 。
②若在滴定终点读取滴定管读数时,俯视标准液液面,使测定结果__________ 。
(1)如图分别是温度计、量筒、滴定管的一部分,其中A仪器的名称为

(2)TiCl4水解生成TiO2•xH2O的化学方程式为
(3)判断滴定终点的现象是
(4)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样wg,消耗c mol/L NH4Fe(SO4)2 标准溶液VmL,则TiO2质量分数表达式为
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果
②若在滴定终点读取滴定管读数时,俯视标准液液面,使测定结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】亚氯酸钠(NaClO2)是一种高效氧化剂和漂白剂,主要用于棉纺、纸浆漂白和鱼药的制造。制备亚氯酸钠的工艺流程如下:
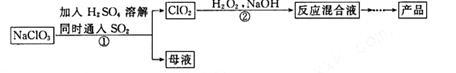
(1)要加快步骤①的反应速率,可采取的措施为_____________________ 。(写一种即可)
(2)步骤①的离子方程式为________ ,每生成标准状况下22.4L的ClO2,转移电子数为_____ 。
(3)步骤②中H2O2的作用是_______________ ;从“反应混合液”到“产品”的过程中先需蒸发溶剂,写出蒸发所需的硅酸盐仪器的名称_________________________ 。
(4)NaClO2产品中通常混有少量NaCl。取样品wg,测得Na的物质的量为nmol,则该样品中NaClO2的物质的量为______ mol。

(1)要加快步骤①的反应速率,可采取的措施为
(2)步骤①的离子方程式为
(3)步骤②中H2O2的作用是
(4)NaClO2产品中通常混有少量NaCl。取样品wg,测得Na的物质的量为nmol,则该样品中NaClO2的物质的量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
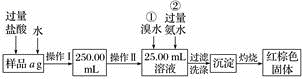
【推荐2】某氯化铁与氯化亚铁的混合物,现要测定其中铁元素的质量分数,实验按以下步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________ 、________ (填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式:_______________________________________ 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3 g,则接下来还应进行的操作是______________________________ 。若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________ 。
Ⅱ.有同学提出,还可以采用以下方法来测定:
(4)溶解样品改用了硫酸,而不再用盐酸,为什么?______________________________ 。
(5)选择的还原剂是否能用铁________ (填“是”或“否”),原因是:___________________ 。
(6)若滴定用掉cmol·L-1KMnO4溶液bmL,则样品中铁元素的质量分数是________________________ 。
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(2)请写出加入溴水发生的离子反应方程式:
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3 g,则接下来还应进行的操作是
Ⅱ.有同学提出,还可以采用以下方法来测定:

(4)溶解样品改用了硫酸,而不再用盐酸,为什么?
(5)选择的还原剂是否能用铁
(6)若滴定用掉cmol·L-1KMnO4溶液bmL,则样品中铁元素的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,在工业上有广泛的应用。它们对应的钠盐同样也是重要的化工产品。
(一)硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3∙5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
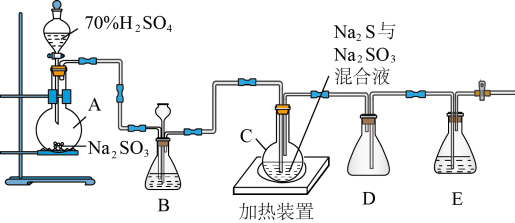
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)烧瓶A中发生反应的离子方程式为:___________ 。装置D的作用是___________ 。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择___________ 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有___________ 。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是___________ 。
(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一、Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是___________ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为___________ g∙L−1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果___________ (填“偏高”“偏低”或“不变”)。其原因是___________ (用化学方程式表示)
(一)硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3∙5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)
 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ) (1)烧瓶A中发生反应的离子方程式为:
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是
(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一、Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
②在上述实验过程中,若有部分HI被空气氧化,则测得结果
您最近一年使用:0次



