实验室常用的浓盐酸密度为1.08 g·mL-1,质量分数为36.5 %。
(1)此浓盐酸的物质的量浓度为__________________ 。
(2)取此浓盐酸50 mL,用蒸馏水稀释为200 mL,稀释后盐酸的物质的量浓度为_____ 。
(3)将13 g 锌投入足量的上述实验所得的稀盐酸中,充分反应后,求:(写出计算过程)
①放出的H2在标准状况下的体积____________ 。
②将生成的H2 通过足量的灼热CuO,求生成铜的质量_________ (假设氢气在反应中没有损失)。
(1)此浓盐酸的物质的量浓度为
(2)取此浓盐酸50 mL,用蒸馏水稀释为200 mL,稀释后盐酸的物质的量浓度为
(3)将13 g 锌投入足量的上述实验所得的稀盐酸中,充分反应后,求:(写出计算过程)
①放出的H2在标准状况下的体积
②将生成的H2 通过足量的灼热CuO,求生成铜的质量
更新时间:2020/10/18 05:54:10
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】向100 ml水中投入Na和Al共15 g,充分反应后,剩余金属为5 g
(1)计算放出H2多少升(标准状况下)______________
(2)过滤出未反应的金属,向滤液中逐滴加入4 mol/L的HCl溶液,生成沉淀的最大值是多少_____________ ?此时消耗HCl溶液的体积是多少?______________
(1)计算放出H2多少升(标准状况下)
(2)过滤出未反应的金属,向滤液中逐滴加入4 mol/L的HCl溶液,生成沉淀的最大值是多少
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·-1的NaOH溶液。请回答:
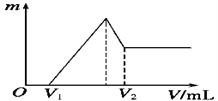
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如图所示,当V1=160 mL时,则金属粉末中n(Mg)=______________ mol,V2=_____________ mL。
(2)若混合物仍为0.1 mol,其中Mg粉物质的量分数为a ,用100 mL2mol·L-1的H2SO4溶解此混合物后,再加入450mL1mol/LNaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是______________ 。

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如图所示,当V1=160 mL时,则金属粉末中n(Mg)=
(2)若混合物仍为0.1 mol,其中Mg粉物质的量分数为a ,用100 mL2mol·L-1的H2SO4溶解此混合物后,再加入450mL1mol/LNaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】填空题:
(1)标准状况下,2.24L Cl2的质量为__________ g。
(2)10.8g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为__________ 。
(3)阻燃剂碱式碳酸铝镁中OH-与CO32-质量之比为51:300,则这两种离子的物质的量之比为____________ 。
(4)将10mL 1.00mol/L Na2CO3溶液与10mL 1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为______________ mol/L(忽略混合前后溶液体积的变化)。
(5)3.5mol Ba(OH)2中约含有____________ 个OH-。
(6)100g质量分数为46%的酒精(CH3CH2OH)溶液中氧原子的物质的量为___________ 。
(7)把 200mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的盐酸恰好反应完全.该混合溶液中c(Na+)为_________________ 。
(1)标准状况下,2.24L Cl2的质量为
(2)10.8g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为
(3)阻燃剂碱式碳酸铝镁中OH-与CO32-质量之比为51:300,则这两种离子的物质的量之比为
(4)将10mL 1.00mol/L Na2CO3溶液与10mL 1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为
(5)3.5mol Ba(OH)2中约含有
(6)100g质量分数为46%的酒精(CH3CH2OH)溶液中氧原子的物质的量为
(7)把 200mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的盐酸恰好反应完全.该混合溶液中c(Na+)为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】(1)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,则该溶液的溶质的物质的量浓度为______ 。
(2)在11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每1molCuSO4可以氧化磷的物质的量是______ 。
(3)两个同容积的密封容器A、B,常温下,A中充入agA气体,B中充入agCH4气体,A与B内的压强之比是4:11,则A的摩尔质量为______ 。
(4)20mLCaCl2溶液加水稀释至100mL,稀释后的溶液中Cl-离子的物质的量浓度为1mol/L,则稀释前CaCl2的物质的量浓度为______ 。
(5)在一定温度和压强下,3L气体A2跟9L体积的气体B2完全化合生成6L体积某气体C,则该气体C的化学式为(用A、B表示)______ 。
(2)在11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每1molCuSO4可以氧化磷的物质的量是
(3)两个同容积的密封容器A、B,常温下,A中充入agA气体,B中充入agCH4气体,A与B内的压强之比是4:11,则A的摩尔质量为
(4)20mLCaCl2溶液加水稀释至100mL,稀释后的溶液中Cl-离子的物质的量浓度为1mol/L,则稀释前CaCl2的物质的量浓度为
(5)在一定温度和压强下,3L气体A2跟9L体积的气体B2完全化合生成6L体积某气体C,则该气体C的化学式为(用A、B表示)
您最近一年使用:0次
【推荐2】将0.1mol镁和铝的混合物溶于100mL2mol·L-1硫酸中,然后滴加1mol·L-1NaOH溶液。回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。

①有关反应的离子方程式为____ 。
②当V1=160时,金属粉末中n(Mg)=____ mol,V2=___ 。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为___ 。
(3)若混合物仍为0.1mol,其中镁粉的物质的量分数为a,用100mL2mol·L-1硫酸溶解此混合物后,再加入450mL1mol·L-1NaOH溶液,所得沉淀中无Al(OH)3,写出满足此条件的a的取值范围:____ 。
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。

①有关反应的离子方程式为
②当V1=160时,金属粉末中n(Mg)=
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为
(3)若混合物仍为0.1mol,其中镁粉的物质的量分数为a,用100mL2mol·L-1硫酸溶解此混合物后,再加入450mL1mol·L-1NaOH溶液,所得沉淀中无Al(OH)3,写出满足此条件的a的取值范围:
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】计算题
(1)在标准状况下,35.5g氯气的体积是_________ L,将其与氢气完全化合,需将生成的气体配制成1L溶液,溶质的物质的量浓度是___________ mol•L-1,将此溶液取出20mL加蒸馏水制成200mL溶液,此冲稀后溶液中溶质的物质的量浓度是___________ mol•L-1。
(2)同质量的NH3和H2S中分子个数比为_____________ 。
(3)在标准状况下甲烷和氧气混合气体的摩尔质量为30g/mol,则混合气体CH4与O2的体积之比为________ ,该混合气体在标况的密度为________________ 。
(4)某同学用CuSO4·5H2O配制480 mL0.1 mol•L-1的CuSO4溶液。某同学通过计算,需要用托盘天平称取____________ gCuSO4·5H2O。
(1)在标准状况下,35.5g氯气的体积是
(2)同质量的NH3和H2S中分子个数比为
(3)在标准状况下甲烷和氧气混合气体的摩尔质量为30g/mol,则混合气体CH4与O2的体积之比为
(4)某同学用CuSO4·5H2O配制480 mL0.1 mol•L-1的CuSO4溶液。某同学通过计算,需要用托盘天平称取
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.4mol 的
的 中所含的
中所含的 的物质的量是
的物质的量是___________ 。
(2)___________ mol 所含原子数与0.2mol
所含原子数与0.2mol 所含原子数相等。
所含原子数相等。
(3)同温同压下,同体积的甲烷 和
和 质量之比为
质量之比为___________ ,质子数之比___________ ;
(4)VL 溶液中含
溶液中含 amol,该
amol,该 溶液的物质的量浓度为
溶液的物质的量浓度为___________ ,取出V/2L再加入水稀释到4VL,则稀释后溶液中 的物质的量浓度是
的物质的量浓度是___________ 。
(1)含0.4mol
 的
的 中所含的
中所含的 的物质的量是
的物质的量是(2)
 所含原子数与0.2mol
所含原子数与0.2mol 所含原子数相等。
所含原子数相等。(3)同温同压下,同体积的甲烷
 和
和 质量之比为
质量之比为(4)VL
 溶液中含
溶液中含 amol,该
amol,该 溶液的物质的量浓度为
溶液的物质的量浓度为 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次



