下表是ⅥA族部分元素的相关性质。
请回答下列问题:
(1)硒的熔点范围可能是______________________ 。
(2)碲的化合价可能有______________________ 。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是________ (填化学式)。
(4)氢硒酸有较强的________ (填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生的化学方程式为_______________________________________ 。
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
________ Al2Te3+( ) ===2Al(OH)3↓+________ H2Te↑
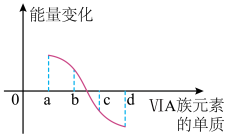
(6)氧族元素单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示氧族中某一元素的单质。则b代表________ ,d代表________ (均写单质名称)。
元素 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1 390 |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热 化合 | 加热 难化合 | 不能直 接化合 |
请回答下列问题:
(1)硒的熔点范围可能是
(2)碲的化合价可能有
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是
(4)氢硒酸有较强的
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
(6)氧族元素单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示氧族中某一元素的单质。则b代表

2020高三·全国·专题练习 查看更多[1]
(已下线)第五章能力提升检测卷-2021年高考化学一轮复习讲练测
更新时间:2020-10-27 16:45:47
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】在原子序数1~18号元素中:(用化学式表示)
(1)与水反应最剧烈的金属是_____________ 。
(2)与水反应最剧烈的非金属单质是_____________ 。
(3)在室温下有颜色的气体单质是_______________________________ 。
(4)最高价氧化物对应的水化物中酸性最强的是_______________________________ 。
(5)除稀有气体外,原子半径最大的元素是____________ ,它的原子结构示意图是_______________ 。
(6)气态氢化物最稳定的物质是_______ 。
(7)写出四原子18电子且既含有极性键又含有非极性键的物质的分子式_______________ ,用电子式表示其形成过程_______________________________________________ 。
(1)与水反应最剧烈的金属是
(2)与水反应最剧烈的非金属单质是
(3)在室温下有颜色的气体单质是
(4)最高价氧化物对应的水化物中酸性最强的是
(5)除稀有气体外,原子半径最大的元素是
(6)气态氢化物最稳定的物质是
(7)写出四原子18电子且既含有极性键又含有非极性键的物质的分子式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】元素周期律反映了元素性质随原子序数递增的周期性变化规律。
(1)元素的性质,特别是化学性质取决于元素的原子结构。钠、镁、铝元素形成的最高价氧化物对应的水化物中,碱性最强的是___________ (填碱的化学式)。
(2)碱金属元素中,137Cs和133Cs之间的关系是互为___________ ,金属钾的氧化物有多种,写出K2O2与CO2反应的化学方程式:___________ 。
(3)可根据元素周期律推测元素的某些性质。如已知卤族元素的性质递变规律,可推知元素砹(At)形成的氢化物HAt的稳定性___________ HI的稳定性(填“大于”或“小于”),AgAt___________ 溶于水(填“易”或“难”)。
(1)元素的性质,特别是化学性质取决于元素的原子结构。钠、镁、铝元素形成的最高价氧化物对应的水化物中,碱性最强的是
(2)碱金属元素中,137Cs和133Cs之间的关系是互为
(3)可根据元素周期律推测元素的某些性质。如已知卤族元素的性质递变规律,可推知元素砹(At)形成的氢化物HAt的稳定性
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.请参考题中图表,已知E1=134kJ/mol,E2=368kJ/mol,根据要求回答问题:
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,△H的变化是_____ (填“增大”、“减小”或“不变”)。写出NO2和CO反应的热化学方程式:_____ 。

(2)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为dkJ/mol,白磷及其完全燃烧的产物的结构如图Ⅱ所示。根据所给信息可求出表中x=_____ kJ/mol(用含a、b、c、d的代表数式表示)

Ⅱ.如图是元素周期表的一部分,回答下列问题。

(3)根据元素周期律,推断下列说法正确的是_____ (填序号)。
①元素Ga在元素周期表中的位置为第四周期第Ⅲ族
②Sn的最高正价为+4
③As的气态氢化物为AsH3
④阴影部分元素氢化物热稳定性最高的是HI
⑤H3AsO4、H2SeO4的酸性强弱:H3AsO4>H2SeO4
⑥氢化物的还原性:H2O>H2S
(4)①Se2Cl2常用作分析试剂,其结构式为_____ 。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是_____ (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
③工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为_____ 。
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,△H的变化是

(2)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ/mol | a | b | c | x |

Ⅱ.如图是元素周期表的一部分,回答下列问题。

(3)根据元素周期律,推断下列说法正确的是
①元素Ga在元素周期表中的位置为第四周期第Ⅲ族
②Sn的最高正价为+4
③As的气态氢化物为AsH3
④阴影部分元素氢化物热稳定性最高的是HI
⑤H3AsO4、H2SeO4的酸性强弱:H3AsO4>H2SeO4
⑥氢化物的还原性:H2O>H2S
(4)①Se2Cl2常用作分析试剂,其结构式为
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
③工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是_________ 。
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是___________ (填字母)。
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因_________________ 。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4和 Ga3+,写出该反应的化学方程式_________ 。
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。
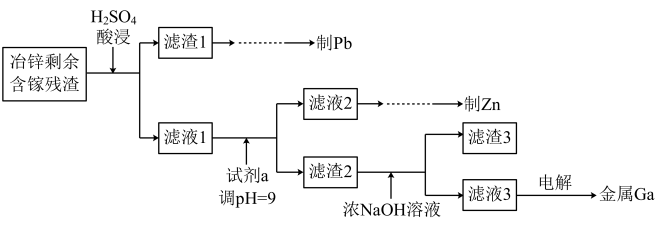
①试剂 a 是_____ 。
②写出得到滤液 3 的离子方程式_______________ 。
③写出电解制镓时的阴极电极反应式__________________ 。
(1)铝在元素周期表中的位置是
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4和 Ga3+,写出该反应的化学方程式
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。

①试剂 a 是
②写出得到滤液 3 的离子方程式
③写出电解制镓时的阴极电极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知铷(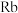 )是37号元素,其相对原子质量是85.5,与钠同主族,回答下列问题:
)是37号元素,其相对原子质量是85.5,与钠同主族,回答下列问题:
(1)铷位于第_________ 周期,其原子半径比钠元素的原子半径_________ (填“大”或“小”)。
(2)铷单质性质活泼,写出它在氯气中燃烧的化学方程式:__________ 。铷单质易与水反应,反应的离子方程式为_______ ,实验表明,铷与水反应比钠与水反应_________ (填“剧烈”或“缓慢”)。
(3)同主族元素的同类化合物的化学性质相似,写出过氧化铷与 反应的化学方程式:
反应的化学方程式:_______ 。
(4)现有铷和另一种碱金属形成的合金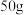 ,当该合金与足量水反应时,可得到
,当该合金与足量水反应时,可得到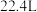 (标准状况下)氢气,则另一种碱金属可能是
(标准状况下)氢气,则另一种碱金属可能是________ (填序号)。
a. b.
b. c.
c. d.
d.
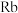 )是37号元素,其相对原子质量是85.5,与钠同主族,回答下列问题:
)是37号元素,其相对原子质量是85.5,与钠同主族,回答下列问题:(1)铷位于第
(2)铷单质性质活泼,写出它在氯气中燃烧的化学方程式:
(3)同主族元素的同类化合物的化学性质相似,写出过氧化铷与
 反应的化学方程式:
反应的化学方程式:(4)现有铷和另一种碱金属形成的合金
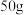 ,当该合金与足量水反应时,可得到
,当该合金与足量水反应时,可得到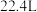 (标准状况下)氢气,则另一种碱金属可能是
(标准状况下)氢气,则另一种碱金属可能是a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次



