中和热的测定实验中取0.5 mol/L的NaOH溶液50 mL与0.25 mol/L的硫酸50 mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
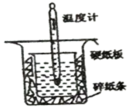
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是___ ,除此之外装置中的一个明显错误是___ 。
(2)若改用60 mL 0.25mol/LH2SO4和50 mL 0.55mol/LNaOH溶液进行反应与上述实验相比,所放出的热量_____ ( 填“相等”或“不相等”)。
(3)近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是l g/cm3,中和后生成溶液的比热c=4.18 J(g·℃),通过以上数据计算中和热△H=____ (结果保留小数点后一位)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)______ 。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把 NaOH溶液倒入盛有硫酸的小烧杯中

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是
(2)若改用60 mL 0.25mol/LH2SO4和50 mL 0.55mol/LNaOH溶液进行反应与上述实验相比,所放出的热量
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把 NaOH溶液倒入盛有硫酸的小烧杯中
更新时间:2020-10-29 19:12:39
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】某同学用50 mL 0.50mol·L-l盐酸与50 mL 0.55 mol·L-1NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量并计算中和热,回答下列问题:
(1)该实验小组做了三次实验,每次取溶液各50 mL,并将实验数据记录如下:


已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4. 2×10-3kJ/(g·℃),则该反应的中和热△H=__________ 。
(2)若用50 mL 0.55 mol·L-1的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会____ (填“偏小”、“偏大”或“不变”),其原因是___________________________________ 。
(3)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_____________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
(1)该实验小组做了三次实验,每次取溶液各50 mL,并将实验数据记录如下:


已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4. 2×10-3kJ/(g·℃),则该反应的中和热△H=
(2)若用50 mL 0.55 mol·L-1的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会
(3)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)实验室用50mL0.50mol/L盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量来计算中和热。该装置缺少一种仪器,该仪器的名称为________ ;实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液,应选择_______ mol/L的溶液进行实验。
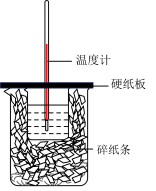
(2)用50mL0.50mol•L-1盐酸与50mL上述所选浓度的NaOH溶液进行中和热的测定。实验数据如表:
回答下列问题:
①若近似认为稀盐酸与NaOH溶液的密度均为1g•cm-3(忽略溶液混合后体积变化),反应所得溶液的比热容c=4.18J•(g•℃)-1,则中和热△H=_______ kJ•mol-1(保留1位小数)。
②上述实验数值结果与理论值57.3kJ•mol-1有偏差,产生偏差的原因不可能是_______ (填字母序号)。
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.用温度计测定盐酸起始温度后直接测定NaOH溶液的温度
D.用量筒量取盐酸的体积时仰视
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol•L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为_______ 。
(4)将V1mL1.0mol•L-1盐酸和V2mL未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如图所示(实验中始终保持V1+V2=50),通过分析图象可知,做该实验时环境温度_______ (填“高于”“低于”或“等于”)22℃,该NaOH溶液的浓度约为_______ mol•L-1。

(1)实验室用50mL0.50mol/L盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量来计算中和热。该装置缺少一种仪器,该仪器的名称为

(2)用50mL0.50mol•L-1盐酸与50mL上述所选浓度的NaOH溶液进行中和热的测定。实验数据如表:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t/℃ | ||
| HCl溶液 | NaOH溶液 | 平均值 | ||
| 1 | 26.0 | 26.2 | 26.1 | 29.4 |
| 2 | 26.0 | 26.4 | 26.2 | 30.5 |
| 3 | 25.9 | 25.9 | 25.9 | 29.3 |
| 4 | 26.2 | 26.4 | 26.3 | 29.5 |
①若近似认为稀盐酸与NaOH溶液的密度均为1g•cm-3(忽略溶液混合后体积变化),反应所得溶液的比热容c=4.18J•(g•℃)-1,则中和热△H=
②上述实验数值结果与理论值57.3kJ•mol-1有偏差,产生偏差的原因不可能是
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.用温度计测定盐酸起始温度后直接测定NaOH溶液的温度
D.用量筒量取盐酸的体积时仰视
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol•L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为
(4)将V1mL1.0mol•L-1盐酸和V2mL未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如图所示(实验中始终保持V1+V2=50),通过分析图象可知,做该实验时环境温度

您最近一年使用:0次
【推荐3】如图是某实验小组改进的中和反应反应热测定实验装置。在塑料瓶中事先加入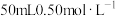 盐酸,然后通过注射器注入
盐酸,然后通过注射器注入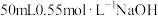 溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
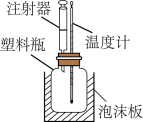
(1)塑料瓶外泡沫板的作用是___________ 。
(2)实验小组按课本装置和改进后的装置分别进行实验,测得实验数据如下:
表中记录的终止温度是指___________ ,根据改进后装置的实验数据计算中和热
___________ (计算结果保留两位小数,近似认为盐酸和 溶液的密度都是
溶液的密度都是 ,中和后溶液的比热容
,中和后溶液的比热容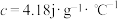 )。
)。
(3)有同学考虑注射器针筒中会有 溶液残留(不超过
溶液残留(不超过 ),认为上述实验会导致所测得反应热偏小,请判断该观点是否正确并说明理由:
),认为上述实验会导致所测得反应热偏小,请判断该观点是否正确并说明理由:___________ 。
(4)如果用 盐酸与
盐酸与 NaOH溶液进行反应,与上述实验相比,所放出的热量
NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”或“不相等”,下同)所求中和热___________ 。
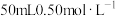 盐酸,然后通过注射器注入
盐酸,然后通过注射器注入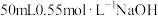 溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
(1)塑料瓶外泡沫板的作用是
(2)实验小组按课本装置和改进后的装置分别进行实验,测得实验数据如下:
| 实验次数 | 起始温度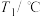 | 终止温度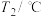 | 温度差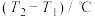 | |||||||
 |  | 平均值 | 改进前 | 改进后 | 改进前 | 改进后 | ||||
| 改进前 | 改进后 | 改进前 | 改进后 | 改进前 | 改进后 | |||||
| 1 | 19.1 | 19.0 | 21.1 | 21.2 | 20.1 | 20.2 | 23.4 | 23.6 | 3.3 | 3.4 |
| 2 | 19.0 | 19.2 | 21.0 | 20.8 | 20.0 | 20.0 | 23.2 | 23.5 | 3.2 | 3.5 |
| 3 | 19.2 | 19.2 | 21.2 | 21.0 | 20.2 | 21.0 | 23.6 | 23.4 | 3.4 | 3.3 |

 溶液的密度都是
溶液的密度都是 ,中和后溶液的比热容
,中和后溶液的比热容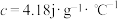 )。
)。(3)有同学考虑注射器针筒中会有
 溶液残留(不超过
溶液残留(不超过 ),认为上述实验会导致所测得反应热偏小,请判断该观点是否正确并说明理由:
),认为上述实验会导致所测得反应热偏小,请判断该观点是否正确并说明理由:(4)如果用
 盐酸与
盐酸与 NaOH溶液进行反应,与上述实验相比,所放出的热量
NaOH溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学兴趣小组要完成中和热的测定实验。
(1)实验桌上备有大小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒(两个)、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的两个玻璃仪器是______ 、____________ 。
(2)烧杯间填满碎泡沫塑料的作用是_____________________________________ 。
(3)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?___ (填“能”或“否”),其原因是____________________________________________________________________________ 。
(4)他们记录的实验数据如下:
已知:Q=cmΔt,反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。根据实验计算结果 写出NaOH溶液与HCl溶液反应的热化学方程式:___________________________________________________________________________ 。
(5)若用KOH代替NaOH,对测定结果_______ (填“有”或“无”)影响;若用醋酸代替HCl做实验,求得的中和热数值将________ (填“偏大”“偏小”“无影响”)。
(1)实验桌上备有大小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒(两个)、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的两个玻璃仪器是
(2)烧杯间填满碎泡沫塑料的作用是
(3)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(4)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
a | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.3 ℃ | |
b | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
(5)若用KOH代替NaOH,对测定结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某学生测定中和反应的反应热,取用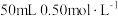 的盐酸和
的盐酸和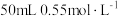 的
的 溶液(密度都是
溶液(密度都是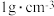 )。
)。

(1)从实验装置上看,图中缺少的一种玻璃仪器是___________ 。烧杯间填满碎纸条的作用是___________ 。
(2)实验中测得的数据如表所示:
①假设反应后溶液的比热容为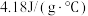 。请利用该学生测得的数据计算生成
。请利用该学生测得的数据计算生成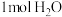 时的反应热:
时的反应热:
___________ 。
②上述结果与 有偏差,产生此偏差的原因可能是
有偏差,产生此偏差的原因可能是___________ (填字母)。
A.用温度计测量盐酸起始温度后直接测量 溶液的温度
溶液的温度
B.一次性把 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中
C.实验装置保温、隔热效果差
③若改用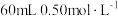 盐酸与
盐酸与 溶液进行反应,与②中实验相比,所放出的热量
溶液进行反应,与②中实验相比,所放出的热量___________ (填“相等”或“不相等”);若用 溶液代替盐酸进行②中实验,测得反应前后温度的变化值
溶液代替盐酸进行②中实验,测得反应前后温度的变化值___________ (填“偏大”“偏小”或“不受影响”)。
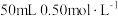 的盐酸和
的盐酸和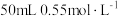 的
的 溶液(密度都是
溶液(密度都是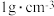 )。
)。
(1)从实验装置上看,图中缺少的一种玻璃仪器是
(2)实验中测得的数据如表所示:
| 实验次数 | 反应物的温度/℃ | 反应前体系的温度 | 反应后体系的温度 | 温度差 | |
| 盐酸 |  溶液 溶液 | t1/℃ | t2/℃ | 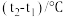 | |
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.5 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
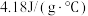 。请利用该学生测得的数据计算生成
。请利用该学生测得的数据计算生成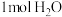 时的反应热:
时的反应热:
②上述结果与
 有偏差,产生此偏差的原因可能是
有偏差,产生此偏差的原因可能是A.用温度计测量盐酸起始温度后直接测量
 溶液的温度
溶液的温度B.一次性把
 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中C.实验装置保温、隔热效果差
③若改用
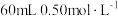 盐酸与
盐酸与 溶液进行反应,与②中实验相比,所放出的热量
溶液进行反应,与②中实验相比,所放出的热量 溶液代替盐酸进行②中实验,测得反应前后温度的变化值
溶液代替盐酸进行②中实验,测得反应前后温度的变化值
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
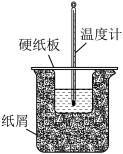
【推荐3】实验室通过实验测定NaOH溶液和盐酸反应的中和热.实验需用约450mL 0.50mol/L NaOH溶液.容量瓶(100mL,250mL,500mL各一个)
(1)配制0.50 mol/L NaOH溶液:将NaOH固体放在_________________ (填实验用品或仪器的名称),用托盘天平___ g NaOH固体.在使用容量瓶前必须进行的操作是_____ .
(2)下列操作会使所配溶液的浓度偏高的是(填序号)______________ .
A.烧杯、玻璃棒没有洗涤
B.转移时有溶液溅出容量瓶外
C.定容时,将容量瓶上、下颠倒摇匀后发现液面低于刻度线再加水
D.容量瓶用蒸馏水洗涤后再用相同溶质的溶液润洗
E.定容时俯视容量瓶刻度线
(3)将50mL 0.50mol/L盐酸与60mL 0.50mol/L NaOH溶液在图所示的装置中进行中和反应.从实验装置上看,图中尚缺少的一种玻璃仪器是________________________ .
(4)一定量的稀盐酸和过量的NaOH溶液反应,当生成1mol H2O时放出的热量为57.3 kJ,则该反应的热化学方程式为___________________________________ .
已知:① HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ·mol-1
② HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=-b kJ·mol-1
③ HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=-c kJ·mol-1
则a、b、c三者的大小关系为_________ (填字母).
A.a>b>c B.b>c>a C.a=b=c D.无法比较
(1)配制0.50 mol/L NaOH溶液:将NaOH固体放在
(2)下列操作会使所配溶液的浓度偏高的是(填序号)
A.烧杯、玻璃棒没有洗涤
B.转移时有溶液溅出容量瓶外
C.定容时,将容量瓶上、下颠倒摇匀后发现液面低于刻度线再加水
D.容量瓶用蒸馏水洗涤后再用相同溶质的溶液润洗
E.定容时俯视容量瓶刻度线
(3)将50mL 0.50mol/L盐酸与60mL 0.50mol/L NaOH溶液在图所示的装置中进行中和反应.从实验装置上看,图中尚缺少的一种玻璃仪器是

(4)一定量的稀盐酸和过量的NaOH溶液反应,当生成1mol H2O时放出的热量为57.3 kJ,则该反应的热化学方程式为
已知:① HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ·mol-1
② HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=-b kJ·mol-1
③ HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=-c kJ·mol-1
则a、b、c三者的大小关系为
A.a>b>c B.b>c>a C.a=b=c D.无法比较
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】考查学生的探究能力,体现了化学学科以实验为基础的特点。请完成下列问题:
I.反应 常用于精盐中碘含量测定。
常用于精盐中碘含量测定。
某学习小组利用该反应探究浓度对反应速率的影响,加入的淀粉溶液利用褪色时间t来度量,t越小,反应速率越快。多组实验得到的数据如下表:
(1)通过分析比较上表数据,得到的结论是_____ 。
(2)表中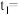
_____ 。
II.用 盐酸与
盐酸与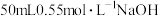 溶液,在如图所示的装置中测定强酸与强碱反应的反应热,实验数据见下表:
溶液,在如图所示的装置中测定强酸与强碱反应的反应热,实验数据见下表:

(3)在该实验中,环形玻璃搅拌棒的运动方向是___________(填字母)。
(4)加入 溶液的正确操作是
溶液的正确操作是______ (填字母)。
A.沿玻璃棒缓慢加入B.一次迅速加入C.分三次加入
(5)某同学实验记录的数据如上表所示,其中记录的终止温度是指______ 温度。
(6)中和后生成的溶液的比热容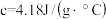 ,为了计算方便,近似地认为该实验所用的酸、碱溶液的密度和比热容与水相同,并忽略实验装置的比热容,已知反应过程中放出的热量Q可用公式
,为了计算方便,近似地认为该实验所用的酸、碱溶液的密度和比热容与水相同,并忽略实验装置的比热容,已知反应过程中放出的热量Q可用公式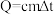 计算,试计算该实验所测反应热为
计算,试计算该实验所测反应热为___________  (结果保留一位小数),其绝对值与实际值
(结果保留一位小数),其绝对值与实际值 有偏差,产生偏差的原因不可能是
有偏差,产生偏差的原因不可能是___________ (填字母)。
A.实验装置保温、隔热效果差
B.用量筒量取 溶液的体积时仰视读数
溶液的体积时仰视读数
C.用温度计测定 溶液起始温度后直接测定稀盐酸的温度
溶液起始温度后直接测定稀盐酸的温度
I.反应
 常用于精盐中碘含量测定。
常用于精盐中碘含量测定。某学习小组利用该反应探究浓度对反应速率的影响,加入的淀粉溶液利用褪色时间t来度量,t越小,反应速率越快。多组实验得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
 |  |  | 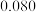 |  | 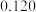 |
 | 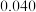 | 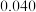 | 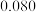 |  | 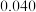 |
 | 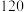 |  |  |  |  |
(1)通过分析比较上表数据,得到的结论是
(2)表中
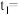
II.用
 盐酸与
盐酸与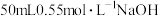 溶液,在如图所示的装置中测定强酸与强碱反应的反应热,实验数据见下表:
溶液,在如图所示的装置中测定强酸与强碱反应的反应热,实验数据见下表:
起始温度 / / | 终止温度/ / / | 温度差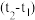 / / | ||
 |  | 平均值 | ||
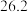 |  |  | ||
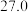 | 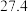 | 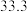 | ||
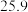 | 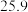 | 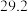 | ||
 | 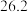 | 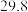 | ||
| A.上下运动 | B.左右运动 | C.顺时针运动 | D.逆时针运动 |
 溶液的正确操作是
溶液的正确操作是A.沿玻璃棒缓慢加入B.一次迅速加入C.分三次加入
(5)某同学实验记录的数据如上表所示,其中记录的终止温度是指
(6)中和后生成的溶液的比热容
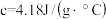 ,为了计算方便,近似地认为该实验所用的酸、碱溶液的密度和比热容与水相同,并忽略实验装置的比热容,已知反应过程中放出的热量Q可用公式
,为了计算方便,近似地认为该实验所用的酸、碱溶液的密度和比热容与水相同,并忽略实验装置的比热容,已知反应过程中放出的热量Q可用公式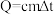 计算,试计算该实验所测反应热为
计算,试计算该实验所测反应热为 (结果保留一位小数),其绝对值与实际值
(结果保留一位小数),其绝对值与实际值 有偏差,产生偏差的原因不可能是
有偏差,产生偏差的原因不可能是A.实验装置保温、隔热效果差
B.用量筒量取
 溶液的体积时仰视读数
溶液的体积时仰视读数C.用温度计测定
 溶液起始温度后直接测定稀盐酸的温度
溶液起始温度后直接测定稀盐酸的温度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:
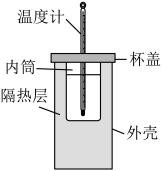
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_________ 。
(2)如果不盖杯盖,所求得的中和反应反应热的绝对值将会__________ (填“偏大”“偏小”或“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,调整反应物用量后所放出的热量与原实验__________ (填“相等”或“不相等”,下同);所求中和反应反应热与原实验________ ,简述理由:_______________ 。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______ (填“偏大”、"偏小”、“无影响”)。
(5)已知:①H+(aq)+OH-(aq)=H2O(1) △H=- 57. 3kJ/ mol;②Ba2+(aq)+ (aq)=BaSO4(s) △H=-13.4kJ/mol。现将100 mL1.0 mol/L Ba(OH)2溶液与100 mL 1.2 mol/L的稀硫酸充分混合,理论上该过程放出的热量为
(aq)=BaSO4(s) △H=-13.4kJ/mol。现将100 mL1.0 mol/L Ba(OH)2溶液与100 mL 1.2 mol/L的稀硫酸充分混合,理论上该过程放出的热量为_______ kJ。

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)如果不盖杯盖,所求得的中和反应反应热的绝对值将会
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,调整反应物用量后所放出的热量与原实验
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
(5)已知:①H+(aq)+OH-(aq)=H2O(1) △H=- 57. 3kJ/ mol;②Ba2+(aq)+
 (aq)=BaSO4(s) △H=-13.4kJ/mol。现将100 mL1.0 mol/L Ba(OH)2溶液与100 mL 1.2 mol/L的稀硫酸充分混合,理论上该过程放出的热量为
(aq)=BaSO4(s) △H=-13.4kJ/mol。现将100 mL1.0 mol/L Ba(OH)2溶液与100 mL 1.2 mol/L的稀硫酸充分混合,理论上该过程放出的热量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、50 mL 0.50mol/L盐酸、50 mL 0.55mol/LNaOH溶液,实验尚缺少的玻璃用品是____ 、____ 。
(2)NaOH稍过量的原因是_______ 。
(3)实验中若改用60 mL 0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液进行上述反应,与上述实验相比,所放出的热量_______ (填“相等”或“不相等”),所求中和热____ (填“相等”或“不相等”),理由是________ 。
(4)他们记录的实验数据如下:
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 J/(℃•g),各物质的密度均为1 g/cm3。根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:____ 。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)______ (填“偏大”“偏小”或“不变”),其原因是_______ 。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、50 mL 0.50mol/L盐酸、50 mL 0.55mol/LNaOH溶液,实验尚缺少的玻璃用品是
(2)NaOH稍过量的原因是
(3)实验中若改用60 mL 0.50 mol/L盐酸和50 mL 0.55 mol/LNaOH溶液进行上述反应,与上述实验相比,所放出的热量
(4)他们记录的实验数据如下:
| 实 验 用 品 | 溶液温度 | ||
| t1 | t2 | ||
| ① | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.3 ℃ |
| 50 mL 0.50mol/L盐酸 | |||
| ② | 50 mL 0.55mol/LNaOH溶液 | 20 ℃ | 23.5 ℃ |
| 50 mL 0.50mol/L盐酸 | |||
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)
您最近一年使用:0次



