常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
请回答:
(1)从①组情况分析, HA是强酸还是弱酸 。
(2)②组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3)从③组实验结果分析,说明HX的电离程度______NaX的水解程度(选填“大于”、“小于”或 “等于”),该混合溶液中离子浓度由大到小的顺序是 。
(4)①组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。写出该混合溶液中下列算式的精确结果(不能作近似计算)。
c(Na+)-c(A-)= mol·L-1 ;c(OH-)-c(HA)= mol·L-1
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况分析, HA是强酸还是弱酸 。
(2)②组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3)从③组实验结果分析,说明HX的电离程度______NaX的水解程度(选填“大于”、“小于”或 “等于”),该混合溶液中离子浓度由大到小的顺序是 。
(4)①组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。写出该混合溶液中下列算式的精确结果(不能作近似计算)。
c(Na+)-c(A-)= mol·L-1 ;c(OH-)-c(HA)= mol·L-1
12-13高二上·湖北武汉·期中 查看更多[4]
(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2012-2013学年四川省雅安市高二下学期期末检测化学试卷(已下线)2014-2015学年重庆市重庆一中高二上学期9月培优复习化学试卷河南省安阳市林虑中学2017-2018学年高二下学期开学考试化学试题
更新时间:2016/12/09 03:22:18
|
【知识点】 盐类的水解
相似题推荐
填空题
|
较难
(0.4)
【推荐1】(1)常温时,FeCl3溶液pH<7,原因是(用离子方程式表示)___________ 。
(2)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,这四种离子的浓度大小关系为____________ ;
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为_____________ ;
③若溶液中c(Na+)=c(CH3COO-),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH)_____ c(CH3COOH)(填“>”、“<”或“=”)。
(3) 对于0.1 mol·L-1的碳酸钠溶液,溶液中离子的浓度大小关系为______________ ;
存在的电荷守恒关系为_______________ 。
(2)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,这四种离子的浓度大小关系为
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为
③若溶液中c(Na+)=c(CH3COO-),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH)
(3) 对于0.1 mol·L-1的碳酸钠溶液,溶液中离子的浓度大小关系为
存在的电荷守恒关系为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】常温下,向 100 mL0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
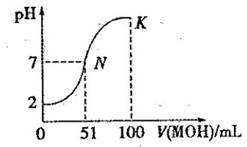
(1)由图中信息可知HA为_________ 酸(填“强”或“弱”),理由是________ 。
(2)常温下一定浓度的MA稀溶液的pH=a,则a_______ 7(填“>”、“<”或“=”),用离子方程式表示其原因:________________ ,此时,溶液中由水电离出的c(OH-)=_________ 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________________ 。
(4)K点对应的溶液中,c(M+)+c(MOH)__________ 2c(A-)(填“>”“<或“=”);若此时溶液的pH=10,则c(MOH)+c(OH-)=________ mol·L-1。

(1)由图中信息可知HA为
(2)常温下一定浓度的MA稀溶液的pH=a,则a
(3)请写出K点所对应的溶液中离子浓度的大小关系:
(4)K点对应的溶液中,c(M+)+c(MOH)
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】某二元酸(化学式用H2A表示)在水中的电离方程式是H2A===H++HA-,HA-⇌H++A2-。回答下列问题:
(1)Na2A溶液显_________________ (填“酸性”、“中性”或“碱性”),理由是_________________ (用离子方程式或必要的文字说明)。
(2)常温下,已知0.1mol·L-1NaHA溶液pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能_________________ 0.11mol·L-1(填“大于”、“等于”或“小于”),理由是_________________ 。
(3)0.1mol·L-1NaHA溶液中各种离子浓度由大到小的顺序是_________________ 。
(4)Na2A溶液中,下列表述正确的是_________________ 。
A.cNa++cH+=cHA-+2cA2-+cOH—
B.cNa+=2(cHA-+cA2-+cH2A)
C.cOH—=cHA-+cH++2cH2A
D.cOH—=cHA-+cH+
(1)Na2A溶液显
(2)常温下,已知0.1mol·L-1NaHA溶液pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能
(3)0.1mol·L-1NaHA溶液中各种离子浓度由大到小的顺序是
(4)Na2A溶液中,下列表述正确的是
A.cNa++cH+=cHA-+2cA2-+cOH—
B.cNa+=2(cHA-+cA2-+cH2A)
C.cOH—=cHA-+cH++2cH2A
D.cOH—=cHA-+cH+
您最近一年使用:0次



