研究含硒工业废水的处理工艺,对控制水体中硒超标具有重要意义。
(1)已知:H2SeO3为二元弱酸,Ka1(H2SeO3)=3.5×10-3,Ka2(H2SeO3)=5.0×10-8。用离子交换树脂处理含Na2SeO3浓度较高的废水时,发生的交换反应为SeO +2RCl=R2SeO3+2Cl-(R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将
+2RCl=R2SeO3+2Cl-(R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将___ (填“增大”“减小”或“不变”)。
(2)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。
已知木炭具有一定的还原性,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600 ℃,保持2 h,过程中木炭包覆纳米零价铁。制备木炭包覆纳米零价铁过程中,木炭的作用有吸附和___ 。木炭包覆纳米零价铁在碱性废水中形成许多微电池,加速SeO 的还原过程。SeO
的还原过程。SeO 在微电池正极上转化为单质Se。
在微电池正极上转化为单质Se。
(3)绿锈[FeⅡaFeⅢb(OH)cXd](X代表阴离子,Ⅱ、Ⅲ表示铁元素的价态)中铁元素以结构态和游离态两种形式存在。由于结构态的双金属氢氧化物层间存在较大的空隙,形成了巨大的比表面积,同时结构态的FeⅡ还原能力优于游离态的FeⅡ,使得绿锈成为一种良好的除硒剂。
①结构态的绿锈具有优异的吸附性能,而且游离态的Fe3+还易水解生成Fe(OH)3胶体进一步吸附SeO 。写出Fe3+水解的离子方程式:
。写出Fe3+水解的离子方程式:___ 。
②不同FeⅡ/FeⅢ组成的绿锈对SeO 去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是
去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是___ 。

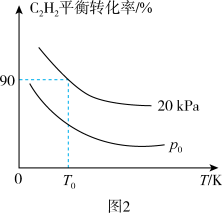
③废水的初始pH会对绿锈去除SeO 的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO
的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO 的去除效果突然迅速减小的原因是
的去除效果突然迅速减小的原因是___ 。
(1)已知:H2SeO3为二元弱酸,Ka1(H2SeO3)=3.5×10-3,Ka2(H2SeO3)=5.0×10-8。用离子交换树脂处理含Na2SeO3浓度较高的废水时,发生的交换反应为SeO
 +2RCl=R2SeO3+2Cl-(R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将
+2RCl=R2SeO3+2Cl-(R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将(2)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。
已知木炭具有一定的还原性,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600 ℃,保持2 h,过程中木炭包覆纳米零价铁。制备木炭包覆纳米零价铁过程中,木炭的作用有吸附和
 的还原过程。SeO
的还原过程。SeO 在微电池正极上转化为单质Se。
在微电池正极上转化为单质Se。(3)绿锈[FeⅡaFeⅢb(OH)cXd](X代表阴离子,Ⅱ、Ⅲ表示铁元素的价态)中铁元素以结构态和游离态两种形式存在。由于结构态的双金属氢氧化物层间存在较大的空隙,形成了巨大的比表面积,同时结构态的FeⅡ还原能力优于游离态的FeⅡ,使得绿锈成为一种良好的除硒剂。
①结构态的绿锈具有优异的吸附性能,而且游离态的Fe3+还易水解生成Fe(OH)3胶体进一步吸附SeO
 。写出Fe3+水解的离子方程式:
。写出Fe3+水解的离子方程式:②不同FeⅡ/FeⅢ组成的绿锈对SeO
 去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是
去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是
③废水的初始pH会对绿锈去除SeO
 的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO
的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO 的去除效果突然迅速减小的原因是
的去除效果突然迅速减小的原因是
更新时间:2020-12-23 19:07:09
|
相似题推荐
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐1】我国科学家成功开发Pd—Fe/Fe2O3催化剂在低温条件下高选择性合成高纯度的乙烯,化学原理如下:
主反应:C2H2(g)+H2(g) C2H4(g) △H1
C2H4(g) △H1
副反应:C2H2(g)+2H2(g) C2H6(g) △H2
C2H6(g) △H2
(1)已知:a.几种共价键的键能如下表所示:
b.C2H2(g)、H2(g)、C2H6(g)的燃烧热△H分别为-1299.6kJ·mol-1、-285.8kJ·mol-1、-1559.8kJ·mol-1。
则△H1=_______ kJ·mol-1;乙烯加氢生成乙烷的热化学方程式是_______ 。
(2)在刚性密闭容器中充入一定量的C2H2(g)和H2(g),发生反应:C2H2(g)+H2(g) C2H4(g)。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图1所示。
C2H4(g)。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图1所示。
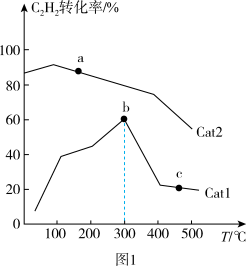
①催化效率较高的是_______ (填“Cat1”或“Cat2”);b点_______ (填“达到”或“未达到”)平衡。
②温度高于300℃,升高温度,b→c的原因可能是_______ (答1条即可)。
(3)在密闭容器中充入1mol C2H2和2mol H2,发生上述两个反应,测得C2H2平衡转化率与温度、压强的关系如图2所示。在T0 K、20kPa下C2H4的选择性等于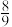 [C2H4选择性=
[C2H4选择性= ]。p0
]。p0_______ 20kPa(填“>”、“<”或“=”)。T0 K下,主反应的平衡常数Kp=_______ kPa-1(Kp为用气体分压计算的平衡常数,气体分压等于气体总压×物质的量分数)。
(4)在恒温刚性密闭容器中通入气体分压比为p(C2H2):p(H2)=1:1的混合气体,已知某反应条件下只发生如下反应(k1、k2为速率常数):
主反应:C2H2(g)+H2(g)=C2H4(g) k1
副反应:C2H4(g)+H2(g)=C2H6(g) k2
实验测得乙烯的净生成速率方程为v(C2H4)=k1p(C2H2)·p(H2)-k2p(C2H4),可推测乙烯的浓度随时间的变化趋势为_______ ,其理由是_______ 。
主反应:C2H2(g)+H2(g)
 C2H4(g) △H1
C2H4(g) △H1副反应:C2H2(g)+2H2(g)
 C2H6(g) △H2
C2H6(g) △H2 (1)已知:a.几种共价键的键能如下表所示:
| 共价键 | H-C | H-H | C=C | C≡C |
| 键能/(kJ·mol-1) | 413.4 | 436 | 615 | 812 |
则△H1=
(2)在刚性密闭容器中充入一定量的C2H2(g)和H2(g),发生反应:C2H2(g)+H2(g)
 C2H4(g)。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图1所示。
C2H4(g)。其他条件相同,在Cat1、Cat2两种催化剂作用下,反应相同时间时C2H2的转化率与温度的关系如图1所示。
①催化效率较高的是
②温度高于300℃,升高温度,b→c的原因可能是
(3)在密闭容器中充入1mol C2H2和2mol H2,发生上述两个反应,测得C2H2平衡转化率与温度、压强的关系如图2所示。在T0 K、20kPa下C2H4的选择性等于
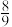 [C2H4选择性=
[C2H4选择性= ]。p0
]。p0
(4)在恒温刚性密闭容器中通入气体分压比为p(C2H2):p(H2)=1:1的混合气体,已知某反应条件下只发生如下反应(k1、k2为速率常数):
主反应:C2H2(g)+H2(g)=C2H4(g) k1
副反应:C2H4(g)+H2(g)=C2H6(g) k2
实验测得乙烯的净生成速率方程为v(C2H4)=k1p(C2H2)·p(H2)-k2p(C2H4),可推测乙烯的浓度随时间的变化趋势为
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐2】化工产品三氯化六氨合钴(III)制备:用H2O2作氧化剂,在大量氨和氯化铵存在下,活性炭为催化剂,将Co(II)氧化为Co(III),制得三氯化六氨合钴(III)配合物。
有关反应式:2CoCl2·6H2O+ 10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+14H2O
已知:①293 K,[Co(NH3)6]Cl3在水中的溶解度为0.26 mol/L。
②钴(II)与氯化铵和氨水作用,经氧化后可生成三种晶体:[Co(NH3)5Cl]Cl2、[Co(NH3)6]Cl3、[Co(NH3)5(H2O)]Cl3。控制不同条件可得不同产物。如温度不同,产物就不同。
(一)制备三氯化六氨合钴(III)粗产品的流程如下:

(二)三氯化六氨合钴(III)粗产品的提纯流程如下:

请回答:
(1)操作B的名称_______ 。
(2)CoCl2在没有铵盐存在时,遇氨水生成蓝色沉淀的离子方程式为_______ 。原料NH4Cl的作用①_______ ;②作为反应物与CoCl2·6H2O生成[Co(H2O)2Cl4]2-。
(3)冷却至10℃后,才在步骤B中逐滴加入H2O2溶液的原因①_______ ;②使反应温和进行。
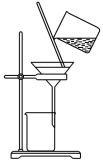
(4)操作A名称_______ ,进行该操作最合适的装置是_______ (填写 “I”或“II”或“III”),操作A后所弃去的沉淀中一定含有的物质为_______ 。
(5)步骤C进行洗涤时要用到两种试剂,先用_______ (填序号,下同)洗涤,后用_______ 洗涤。
A.饱和氯化钠溶液 B.无水乙醇 C.浓盐酸
有关反应式:2CoCl2·6H2O+ 10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+14H2O
已知:①293 K,[Co(NH3)6]Cl3在水中的溶解度为0.26 mol/L。
②钴(II)与氯化铵和氨水作用,经氧化后可生成三种晶体:[Co(NH3)5Cl]Cl2、[Co(NH3)6]Cl3、[Co(NH3)5(H2O)]Cl3。控制不同条件可得不同产物。如温度不同,产物就不同。
(一)制备三氯化六氨合钴(III)粗产品的流程如下:

(二)三氯化六氨合钴(III)粗产品的提纯流程如下:

请回答:
(1)操作B的名称
(2)CoCl2在没有铵盐存在时,遇氨水生成蓝色沉淀的离子方程式为
(3)冷却至10℃后,才在步骤B中逐滴加入H2O2溶液的原因①
(4)操作A名称
| 装置I | 装置II | 装置III |
 |  |  |
(5)步骤C进行洗涤时要用到两种试剂,先用
A.饱和氯化钠溶液 B.无水乙醇 C.浓盐酸
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐3】为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
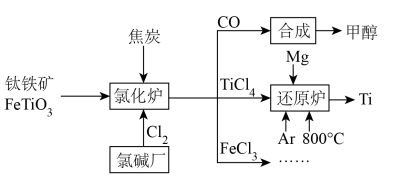
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:___________ ;已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是___________ 。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s) ΔH=-641 kJ·mol-1
②2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s) ΔH=-512 kJ·mol-1
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=___________ 。
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是___________ 。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-=2CO +6H2O,该电池中正极上的电极反应式为
+6H2O,该电池中正极上的电极反应式为___________ 。工作一段时间后,测得溶液的pH___________ (填“减小”、“增大”或“不变”)。

请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s) ΔH=-641 kJ·mol-1
②2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s) ΔH=-512 kJ·mol-1
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-=2CO
 +6H2O,该电池中正极上的电极反应式为
+6H2O,该电池中正极上的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
解题方法
【推荐1】硫代硫酸钠( )是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。
)是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。
I. 的制备。制备原理为:
的制备。制备原理为: 。
。
(1)用化学用语解释通入 之前,混合溶液呈碱性的主要原因是:
之前,混合溶液呈碱性的主要原因是: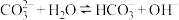 ,
,___________ 。
(2)为了保证硫代硫酸钠的产量,实验中通入的 ,能否过量
,能否过量___________ (填“能”或“否”);测定该混合溶液 的操作方法:
的操作方法:___________ 。
II.探究 与金属阳离子的反应。
与金属阳离子的反应。
资料:i.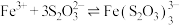 (紫黑色)
(紫黑色)
ⅱ. 为白色沉淀,
为白色沉淀, 可溶于过量的
可溶于过量的 溶液
溶液
(3)根据实验①的现象,初步判断最终 被
被 还原为
还原为 。该反应的离子方程式:
。该反应的离子方程式:___________ 。试从化学反应速率和平衡的角度解释实验①的现象:___________ 。
(4)进一步探究 和
和 反应。
反应。
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数: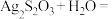
___________ 。
(5)根据以上实验可知: 与金属离子反应的多样性与
与金属离子反应的多样性与_______ 和_____ 有关。
 )是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。
)是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。I.
 的制备。制备原理为:
的制备。制备原理为: 。
。(1)用化学用语解释通入
 之前,混合溶液呈碱性的主要原因是:
之前,混合溶液呈碱性的主要原因是: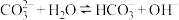 ,
,(2)为了保证硫代硫酸钠的产量,实验中通入的
 ,能否过量
,能否过量 的操作方法:
的操作方法:II.探究
 与金属阳离子的反应。
与金属阳离子的反应。资料:i.
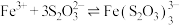 (紫黑色)
(紫黑色)ⅱ.
 为白色沉淀,
为白色沉淀, 可溶于过量的
可溶于过量的 溶液
溶液| 装置 | 编号 | 试剂X | 实验现象 |
 | ① |  溶液 溶液 | 混合后溶液先变成紫黑色, 后溶液几乎变为无色 后溶液几乎变为无色 |
| ② |  溶液 溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
 被
被 还原为
还原为 。该反应的离子方程式:
。该反应的离子方程式:(4)进一步探究
 和
和 反应。
反应。| 装置 | 编号 | 试剂X | 实验现象 |
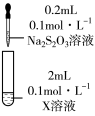 | ③ |  溶液 溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
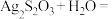
(5)根据以上实验可知:
 与金属离子反应的多样性与
与金属离子反应的多样性与
您最近一年使用:0次



