某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___________ ;
(2)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是___________ ;
(3)要加快上述实验中气体产生的速率,还可采取的措施有___________ (答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=___________ ,V6=___________ ,V9=___________ ;
②反应一段时间后,实验A中的金属呈___________ 色,实验E中的金属呈___________ 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___________ 。
(1)硫酸铜溶液可以加快氢气生成速率的原因是
(2)实验室中现有Na2SO3、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是
(3)要加快上述实验中气体产生的速率,还可采取的措施有
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验/混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
更新时间:2021-03-01 12:50:03
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
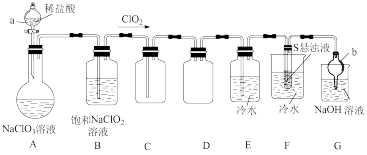
【推荐1】二氧化氯常用作氧化剂、脱臭剂、保鲜剂、漂白剂等。因其具有对人体及动物无害以及对环境不造成二次污染等特点备受人们青睐。某实验室设计如图装置制取并收集 且探究其性质。
且探究其性质。
已知:
① 是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点
是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点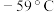 ,沸点
,沸点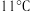 ,受热易分解;
,受热易分解;
②稀盐酸与 反应或
反应或 与
与 溶液反应均可制取
溶液反应均可制取 。
。
回答下列问题:
(1)仪器b的名称是___________ 。
(2)装置A中发生反应: +
+___________ 
 ,滴加稀盐酸时,应缓慢滴加,其主要原因是
,滴加稀盐酸时,应缓慢滴加,其主要原因是___________ 。
(3)根据(2)试分析装置B的作用:___________ (用化学方程式说明)。
(4)装置F中可得到两种强酸的混合溶液,该装置中的现象为___________ ,反应的化学方程式为___________ 。
(5)已知在酸性条件下 可发生反应生成
可发生反应生成 并释放出
并释放出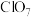 ,向
,向 溶液中滴加盐酸,反应剧烈,若将盐酸换成等
溶液中滴加盐酸,反应剧烈,若将盐酸换成等 的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是
的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是___________ 。
 且探究其性质。
且探究其性质。
已知:
①
 是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点
是一种易溶于水的黄绿色气体,与冷水几乎不反应,与热水能反应,其熔点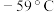 ,沸点
,沸点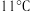 ,受热易分解;
,受热易分解;②稀盐酸与
 反应或
反应或 与
与 溶液反应均可制取
溶液反应均可制取 。
。回答下列问题:
(1)仪器b的名称是
(2)装置A中发生反应:
 +
+
 ,滴加稀盐酸时,应缓慢滴加,其主要原因是
,滴加稀盐酸时,应缓慢滴加,其主要原因是(3)根据(2)试分析装置B的作用:
(4)装置F中可得到两种强酸的混合溶液,该装置中的现象为
(5)已知在酸性条件下
 可发生反应生成
可发生反应生成 并释放出
并释放出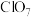 ,向
,向 溶液中滴加盐酸,反应剧烈,若将盐酸换成等
溶液中滴加盐酸,反应剧烈,若将盐酸换成等 的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是
的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】NO2(红棕色)和N2O4(无色)之间发生反应:N2O4(g)⇌2NO2(g)。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
(1)该反应为吸热反应,则反应物的化学键断裂要吸收的能量_______ (填“大于”、“小于”“等于”)生成物的化学键形成要放出的能量。
(2)下列可以说明该反应达到平衡的是_______。
(3)在温度为T的条件下,向该恒容密闭容器中充入0.04mol/LN2O4,c(NO2)随时间的变化曲线如图所示。

①在图中画出0~16min时间段内,c(N2O4)随时间的变化曲线_______ 。
②1~4四个点中,v正=v逆的点有_______ 个。
③在图中0~12min时间段内,N2O4的平均反应速率是_______ mol/(L·min)。
④反应进行到16min时,N2O4的转化率是_______ 。
⑤下列措施能使该反应速率加快的是_______ 。
A.增大NO2的浓度 B.增大容器体积
C.加入合适的催化剂 D.恒容条件下充入He
(1)该反应为吸热反应,则反应物的化学键断裂要吸收的能量
(2)下列可以说明该反应达到平衡的是_______。
| A.c(N2O4):c(NO2)=1:2 | B.v正(N2O4)=2v逆(NO2) |
| C.容器内气体的颜色不再变化 | D.混合气体的压强不再变化 |

①在图中画出0~16min时间段内,c(N2O4)随时间的变化曲线
②1~4四个点中,v正=v逆的点有
③在图中0~12min时间段内,N2O4的平均反应速率是
④反应进行到16min时,N2O4的转化率是
⑤下列措施能使该反应速率加快的是
A.增大NO2的浓度 B.增大容器体积
C.加入合适的催化剂 D.恒容条件下充入He
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】环成二烯(C5H6)是一种重要的有机化工原料。
Ⅰ.环戊二烯容易反应生成双环戊二烯(C10H12):2C5H6(g) C10H12(g)。不同温度下,溶液中环戊二烯(C5H6)浓度(初始浓度为1.5mol·L-1 )与反应时间的关系如图所示。
C10H12(g)。不同温度下,溶液中环戊二烯(C5H6)浓度(初始浓度为1.5mol·L-1 )与反应时间的关系如图所示。
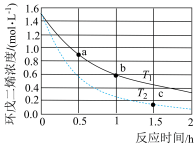
(1)反应开始至b点时,用双环戊二烯(C10H12)表示的平均速率为_________ mol·L-1·h-1 (小数表示)。
(2)
____  (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
(3)a点的正反应速率___________ b点的逆反应速率(填“大于”、“小于”或“等于”)
Ⅱ.可用环戊二烯(C5H6)制备环戊烯(C5H8)。有如下反应:
反应i:C5H8(g) C5H6(g)+ H2(g) ∆H1=+100.3kJ·mol-1
C5H6(g)+ H2(g) ∆H1=+100.3kJ·mol-1
反应ii:2HI(g) H2 (g) + I2(g) ∆H2=+11.0 kJ·mol-1
H2 (g) + I2(g) ∆H2=+11.0 kJ·mol-1
反应iii:C5H8(g) + I2(g) C5H6(g) + 2HI(g) ∆H3
C5H6(g) + 2HI(g) ∆H3
(4)反应iii的焓变∆H3=___________ kJ·mol-1
(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应iii,起始总压为P0,平衡时总压为1.2 P0。
①平衡时环戊烯(C5H8)的体积分数为___________ %。
②用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算压强平衡常数Kp =______ 。
A.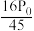 B.
B. 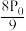 C.
C.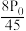 D.
D.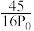
③达到平衡后,欲增加环戊烯(C5H8)的平衡转化率,可采取的措施有______________ 。
A.加压 B. 适当升高温度 C.增大环戊烯C5H8的浓度 D.适当降低压强
Ⅰ.环戊二烯容易反应生成双环戊二烯(C10H12):2C5H6(g)
 C10H12(g)。不同温度下,溶液中环戊二烯(C5H6)浓度(初始浓度为1.5mol·L-1 )与反应时间的关系如图所示。
C10H12(g)。不同温度下,溶液中环戊二烯(C5H6)浓度(初始浓度为1.5mol·L-1 )与反应时间的关系如图所示。
(1)反应开始至b点时,用双环戊二烯(C10H12)表示的平均速率为
(2)

 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)(3)a点的正反应速率
Ⅱ.可用环戊二烯(C5H6)制备环戊烯(C5H8)。有如下反应:
反应i:C5H8(g)
 C5H6(g)+ H2(g) ∆H1=+100.3kJ·mol-1
C5H6(g)+ H2(g) ∆H1=+100.3kJ·mol-1 反应ii:2HI(g)
 H2 (g) + I2(g) ∆H2=+11.0 kJ·mol-1
H2 (g) + I2(g) ∆H2=+11.0 kJ·mol-1 反应iii:C5H8(g) + I2(g)
 C5H6(g) + 2HI(g) ∆H3
C5H6(g) + 2HI(g) ∆H3 (4)反应iii的焓变∆H3=
(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应iii,起始总压为P0,平衡时总压为1.2 P0。
①平衡时环戊烯(C5H8)的体积分数为
②用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算压强平衡常数Kp =
A.
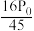 B.
B. 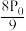 C.
C.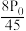 D.
D.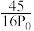
③达到平衡后,欲增加环戊烯(C5H8)的平衡转化率,可采取的措施有
A.加压 B. 适当升高温度 C.增大环戊烯C5H8的浓度 D.适当降低压强
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某同学设计计如下图所示装置(部分夹持装置已略去)进行实验探究:
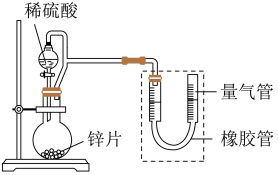
(1)用上述装置探究影响化学反应速率的因素。以生成9.0 mL气体为计时终点,结果为t1>t2。
①比较实验I和Ⅱ可以得出的实验结论是_______________ 。
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是_________ (填序号)。
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用________ (填序号)。
A.稀HCl B .NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_____________ 。

(1)用上述装置探究影响化学反应速率的因素。以生成9.0 mL气体为计时终点,结果为t1>t2。
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用
A.稀HCl B .NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】反应Sn+H2SO4=SnSO4+H2↑的能量变化趋势,如图所示:
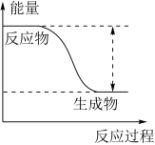
(1)该反应为_______ 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)。
(3)若将上述反应设计成原电池,石墨棒为原电池某一极材料,则石墨棒为_______ 极(填“正”或“负”)。石墨棒上产生的现象为_______ ,该极上发生的电极反应为_______ ,原电池工作时溶液中的 移向
移向_______ 极移动(填正或负)。
(4)实验后同学们经过充分讨论,观察原电池反应特点,认为符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是_______ 。
A.CO2+H2O=H2CO3 B.NaOH+HCl=NaCl+H2O C.2H2+O2=2H2O D.CuO+H2SO4=CuSO4+H2O
以稀硫酸为电解质溶液,在所选反应设计成原电池,该电池负极反应为:_______ 。

(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是_______(填字母)。
| A.改锡片为锡粉 | B.加入少量醋酸钠固体 |
| C.滴加少量CuSO4 | D.将稀硫酸改为98%的浓硫酸 |
 移向
移向(4)实验后同学们经过充分讨论,观察原电池反应特点,认为符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是
A.CO2+H2O=H2CO3 B.NaOH+HCl=NaCl+H2O C.2H2+O2=2H2O D.CuO+H2SO4=CuSO4+H2O
以稀硫酸为电解质溶液,在所选反应设计成原电池,该电池负极反应为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_______ ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是_______ ;
(3)实验室中现有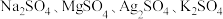 等4种溶液,可与上述实验中
等4种溶液,可与上述实验中 溶液起相似作用的是
溶液起相似作用的是_______ ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有_______ (答两种)
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
①请完成此实验设计,其中:V1=_______ ,
_______ ,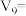
_______ 。
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈_______ 色;
③该同学最后得出的结论为:当加入少量 溶液时,生成氢气的速率会大大提高,但当加入的
溶液时,生成氢气的速率会大大提高,但当加入的 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______ 。
(1)上述实验中发生反应的化学方程式有
(2)硫酸铜溶液可以加快氢气生成速率的原因是
(3)实验室中现有
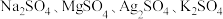 等4种溶液,可与上述实验中
等4种溶液,可与上述实验中 溶液起相似作用的是
溶液起相似作用的是(4)要加快上述实验中气体产生的速率,还可采取的措施有
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
| 实验 混合溶液 | A | B | C | D | E | F |
 | 30 | V1 | V2 | V3 | V4 | V5 |
饱和 溶液/mL 溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
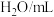 | V7 | V8 | V9 | V10 | 10 | 0 |

②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈
③该同学最后得出的结论为:当加入少量
 溶液时,生成氢气的速率会大大提高,但当加入的
溶液时,生成氢气的速率会大大提高,但当加入的 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
您最近一年使用:0次



