三草酸合铁酸钾(K3[Fe(C2O4)3]),为翠绿色晶体,溶于水,难溶于乙醇,230℃时分解。该物质对光敏感,光照下即发生分解。实验室以废铁屑为原料制备三草酸合铁酸钾晶体,然后探究三草酸合铁酸钾受热分解的产物,并对所得气体产物和固体产物进行验证。
I.实验室以废铁屑为原料制备三草酸合铁酸钾晶体反应过程如下图所示:
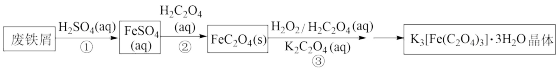
请回答下列问题:
(1)废铁屑需要在5%Na2CO3溶液中加热数分钟,并洗涤干净。用化学用语和必要的文字说明Na2CO3溶液的作用是______ 。
(2)步骤③生成了K3[Fe(C2O4)3],写出该反应的化学方程式______ 。
(3)得到K3[Fe(C2O4)3]溶液后,需要加入乙醇,其目的是______ 。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是______ 。
II.某化学研究小组探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。

(5)实验开始时缓缓通入氮气一段时间后,应先加热反应管______ (填“A”或“E”)。
(6)待反应完全后,停止加热,停止加热前不需要先断开A、B的连接处和E、F的连接处,原因是______ 。
(7)足量NaOH溶液的作用是______ 。
(8)能证明分解产物中有CO气体生成的实验现象是______ 。
(9)研究小组为探究反应后所得固体中铁元素的存在形式,取A中充分反应后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到4.4g黑色粉末(铁元素不可能以三价形式存在),4.4g该黑色粉末溶于足量稀硝酸中,收集到标准状况下NO气体1.12L,通过计算即可判断出黑色粉末的成分,依据黑色粉末的组成,写出该黑色粉末和足量稀硝酸反应总的离子方程式______ 。
I.实验室以废铁屑为原料制备三草酸合铁酸钾晶体反应过程如下图所示:
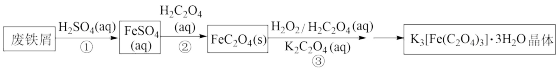
请回答下列问题:
(1)废铁屑需要在5%Na2CO3溶液中加热数分钟,并洗涤干净。用化学用语和必要的文字说明Na2CO3溶液的作用是
(2)步骤③生成了K3[Fe(C2O4)3],写出该反应的化学方程式
(3)得到K3[Fe(C2O4)3]溶液后,需要加入乙醇,其目的是
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是
II.某化学研究小组探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。

(5)实验开始时缓缓通入氮气一段时间后,应先加热反应管
(6)待反应完全后,停止加热,停止加热前不需要先断开A、B的连接处和E、F的连接处,原因是
(7)足量NaOH溶液的作用是
(8)能证明分解产物中有CO气体生成的实验现象是
(9)研究小组为探究反应后所得固体中铁元素的存在形式,取A中充分反应后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到4.4g黑色粉末(铁元素不可能以三价形式存在),4.4g该黑色粉末溶于足量稀硝酸中,收集到标准状况下NO气体1.12L,通过计算即可判断出黑色粉末的成分,依据黑色粉末的组成,写出该黑色粉末和足量稀硝酸反应总的离子方程式
20-21高三下·山西·阶段练习 查看更多[3]
山西省2021届高三3月高考考前适应性测试理科综合(A)化学试题四川省绵阳市2023届高三零诊模拟检测试题理科综合化学试题(已下线)03 物质成分或反应产物探究类综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
更新时间:2021-04-04 19:19:35
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】莫尔盐[ (相对分子质量为392)]能溶于水,难溶于乙醇,较硫酸亚铁不易被氧气氧化,是实验中代替硫酸亚铁使用的重要试剂。某兴趣小组欲制备莫尔盐并测定其纯度。采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
(相对分子质量为392)]能溶于水,难溶于乙醇,较硫酸亚铁不易被氧气氧化,是实验中代替硫酸亚铁使用的重要试剂。某兴趣小组欲制备莫尔盐并测定其纯度。采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
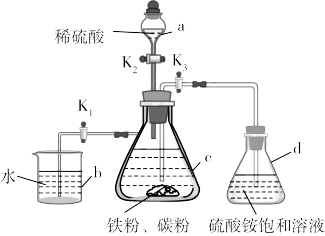
(1)配制本实验所需溶液的蒸馏水,均需经煮沸并迅速冷却后再使用,目的是防止_______ 。
(2)按图连好装置,检验气密性后,将过量铁屑和少量碳粉加入c中,加入其它试剂,为保证硫酸顺利滴入c中,应采取的操作是_______ 。
(3)c中碳粉的作用_______ 。
(4)充分反应一段时间后,打开K3,关闭K1、K2。c中液体会自动流入d中。则d中发生的主要反应化学方程式为_______ 。
(5)实验小组对样品进行纯度检测,取9.000 g样品配成溶液,用0.1000 mol/L的酸性KMnO4溶液滴定。消耗酸性KMnO4溶液30.00 mL,该反应的离子方程式为_______ 该样品的纯度为_______ %(保留至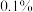 )。
)。
 (相对分子质量为392)]能溶于水,难溶于乙醇,较硫酸亚铁不易被氧气氧化,是实验中代替硫酸亚铁使用的重要试剂。某兴趣小组欲制备莫尔盐并测定其纯度。采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
(相对分子质量为392)]能溶于水,难溶于乙醇,较硫酸亚铁不易被氧气氧化,是实验中代替硫酸亚铁使用的重要试剂。某兴趣小组欲制备莫尔盐并测定其纯度。采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
(1)配制本实验所需溶液的蒸馏水,均需经煮沸并迅速冷却后再使用,目的是防止
(2)按图连好装置,检验气密性后,将过量铁屑和少量碳粉加入c中,加入其它试剂,为保证硫酸顺利滴入c中,应采取的操作是
(3)c中碳粉的作用
(4)充分反应一段时间后,打开K3,关闭K1、K2。c中液体会自动流入d中。则d中发生的主要反应化学方程式为
(5)实验小组对样品进行纯度检测,取9.000 g样品配成溶液,用0.1000 mol/L的酸性KMnO4溶液滴定。消耗酸性KMnO4溶液30.00 mL,该反应的离子方程式为
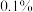 )。
)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】莫尔盐[ (相对分子质量为392)]能溶于水,难溶于乙醇,较硫酸亚铁不易被氧气氧化,是实验中代替硫酸亚铁使用的重要试剂。某兴趣小组欲制备莫尔盐并测定其纯度。采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
(相对分子质量为392)]能溶于水,难溶于乙醇,较硫酸亚铁不易被氧气氧化,是实验中代替硫酸亚铁使用的重要试剂。某兴趣小组欲制备莫尔盐并测定其纯度。采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
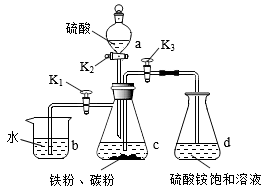
(1)仪器a的名称为_____________ 。配制本实验所需溶液的蒸馏水,均需经煮沸并迅速冷却后再使用,目的是____________ 。
(2)按图连好装置,检验气密性后,将过量铁屑和少量碳粉加入c中,加入其它试剂,打开仪器a的塞子,然后旋开K2,为保证硫酸顺利滴入c中,还应采取的操作是________________________ 。
(3)c中加入少量碳粉的作用是________________________ 。
(4)为加快反应速率,需将c中试剂温度保持在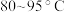 ,一般采取的加热方式是
,一般采取的加热方式是_____________ 。
(5)充分反应一段时间后,打开K3,关闭K1、K2。c中液体会自动流入d中,利用的原理是____________ ,此时,d中发生的主要反应的化学方程式为____________ 。
(6)制备结束后,将d中固液混合物过滤,所得莫尔盐可用_______________ (填试剂名称)进行洗涤,洗涤后用烘箱进行烘干。
(7)实验小组对样品进行纯度检测,取9.000 g样品配成溶液,用0.1000 mol/L的酸性 溶液滴定。消耗酸性
溶液滴定。消耗酸性 溶液30.00 mL,该样品的纯度为
溶液30.00 mL,该样品的纯度为______________ %(保留至 )。
)。
 (相对分子质量为392)]能溶于水,难溶于乙醇,较硫酸亚铁不易被氧气氧化,是实验中代替硫酸亚铁使用的重要试剂。某兴趣小组欲制备莫尔盐并测定其纯度。采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
(相对分子质量为392)]能溶于水,难溶于乙醇,较硫酸亚铁不易被氧气氧化,是实验中代替硫酸亚铁使用的重要试剂。某兴趣小组欲制备莫尔盐并测定其纯度。采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
(1)仪器a的名称为
(2)按图连好装置,检验气密性后,将过量铁屑和少量碳粉加入c中,加入其它试剂,打开仪器a的塞子,然后旋开K2,为保证硫酸顺利滴入c中,还应采取的操作是
(3)c中加入少量碳粉的作用是
(4)为加快反应速率,需将c中试剂温度保持在
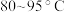 ,一般采取的加热方式是
,一般采取的加热方式是(5)充分反应一段时间后,打开K3,关闭K1、K2。c中液体会自动流入d中,利用的原理是
(6)制备结束后,将d中固液混合物过滤,所得莫尔盐可用
(7)实验小组对样品进行纯度检测,取9.000 g样品配成溶液,用0.1000 mol/L的酸性
 溶液滴定。消耗酸性
溶液滴定。消耗酸性 溶液30.00 mL,该样品的纯度为
溶液30.00 mL,该样品的纯度为 )。
)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】实验室用如图所示装置制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]。

已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)尾气吸收
由于加入的铁粉不纯,反应过程中会产生少量PH3气体,故需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu,则该反应的化学方程式为____ 。
(2)药品用量
将0.7g铁粉、10mL1mol·L-1H2SO4溶液加入烧瓶中反应。采取上述原料配比除铁粉不纯外,主要原因是___ 。
(3)制备(NH4)2Fe(SO4)2·6H2O
先制备FeSO4溶液:保持温度在70℃~80℃之间,至反应无明显气泡产生后,停止加热,趁热过滤,称量残余固体质量。向FeSO4溶液中加入一定质量的(NH4)2SO4固体,在70℃~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为____ 。
(4)产品检验
请补充完整测定产品中SO 含量的实验方案:准确称取0.4g样品,将样品溶于70mL水中,加入2mol·L-1的HCl溶液酸化,
含量的实验方案:准确称取0.4g样品,将样品溶于70mL水中,加入2mol·L-1的HCl溶液酸化,___ ,将沉淀移入坩埚,灼烧至恒重称量,记录数据。
(5)已知酸性高锰酸钾溶液可与Fe2+发生氧化还原反应。现称取4.198g(NH4)2Fe(SO4)2·6H2O产品(杂质只有FeSO4·7H2O)溶于稀硫酸中,然后用0.10mol·L-1的高锰酸钾溶液滴定,达到终点时消耗了22.00mL高锰酸钾溶液。
①滴定终点时的现象是____ 。
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为(结果保留四位有效数字)____ 。

已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)尾气吸收
由于加入的铁粉不纯,反应过程中会产生少量PH3气体,故需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu,则该反应的化学方程式为
(2)药品用量
将0.7g铁粉、10mL1mol·L-1H2SO4溶液加入烧瓶中反应。采取上述原料配比除铁粉不纯外,主要原因是
(3)制备(NH4)2Fe(SO4)2·6H2O
先制备FeSO4溶液:保持温度在70℃~80℃之间,至反应无明显气泡产生后,停止加热,趁热过滤,称量残余固体质量。向FeSO4溶液中加入一定质量的(NH4)2SO4固体,在70℃~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为
(4)产品检验
请补充完整测定产品中SO
 含量的实验方案:准确称取0.4g样品,将样品溶于70mL水中,加入2mol·L-1的HCl溶液酸化,
含量的实验方案:准确称取0.4g样品,将样品溶于70mL水中,加入2mol·L-1的HCl溶液酸化,(5)已知酸性高锰酸钾溶液可与Fe2+发生氧化还原反应。现称取4.198g(NH4)2Fe(SO4)2·6H2O产品(杂质只有FeSO4·7H2O)溶于稀硫酸中,然后用0.10mol·L-1的高锰酸钾溶液滴定,达到终点时消耗了22.00mL高锰酸钾溶液。
①滴定终点时的现象是
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为(结果保留四位有效数字)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH CH2===CH2↑+H2O, CH2===CH2+Br2→BrCH2CH2Br
CH2===CH2↑+H2O, CH2===CH2+Br2→BrCH2CH2Br
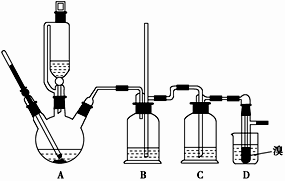
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________ (填字母)。
a.引发反应 b.加快反应速率 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________ (填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是_______________ 。
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________ (填“上”或“下”)层。
(5)若产物中有少量未反应的Br2,最好用______ (填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用________ 的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是____________________________ .
CH3CH2OH
 CH2===CH2↑+H2O, CH2===CH2+Br2→BrCH2CH2Br
CH2===CH2↑+H2O, CH2===CH2+Br2→BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:

有关数据列表如下:
| 物质名称 | 乙醇 | 1,2二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是
a.引发反应 b.加快反应速率 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在
(5)若产物中有少量未反应的Br2,最好用
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用
(7)反应过程中应用冷水冷却装置D,其主要目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】硫酸铜的制备实验是化学实验教学中一个必做实验,某学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸反应,实验中用铜和浓硫酸加热使之完全反应,将溶液通过蒸发、结晶等操作得到硫酸铜晶体。
(1)根据上述实验和反应,比较浓硫酸与稀硫酸的性质,浓硫酸具有__________________ 。
(2)该反应的化学方程式为__________________________ 。
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2+ 2H2SO4= 2CuSO4+ 2H2O ,但反应速率太慢,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(3)Fe2(SO4)3的作用是________________ 。
(4)得到的混合液可以用下列四种物质中的______ 调节溶液的pH =2~4,使Fe3+ 形成Fe(OH)3沉淀而除去:
(5)请根据以上内容,对这两个实验方案进行评价,填下表:
实验一:
因铜不能与稀硫酸反应,实验中用铜和浓硫酸加热使之完全反应,将溶液通过蒸发、结晶等操作得到硫酸铜晶体。
(1)根据上述实验和反应,比较浓硫酸与稀硫酸的性质,浓硫酸具有
(2)该反应的化学方程式为
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2+ 2H2SO4= 2CuSO4+ 2H2O ,但反应速率太慢,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(3)Fe2(SO4)3的作用是
(4)得到的混合液可以用下列四种物质中的
| A.NaOH | B.CuO | C. CuCO3 | D.Fe |
| 实 验 (一) | 实 验 (二) | |
| 主要优点 | 操作简便 | (1)原料充分转化为产品 (2)没有有害气体排放 |
| 主要缺点 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
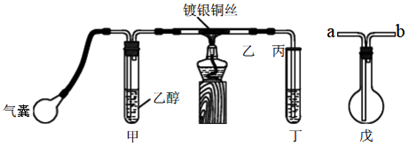
(1)甲装置常常浸在70~80℃的水浴中,目的是__________________ 。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。 乙醇的催化氧化反应是________ 反应(填“放热”或“吸热”)
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_____ 、_____ 接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在_____ 中。

(1)甲装置常常浸在70~80℃的水浴中,目的是
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。 乙醇的催化氧化反应是
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接
您最近一年使用:0次



