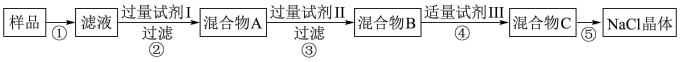氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过如图操作流程:
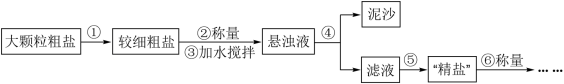
(1)操作①中必须用到的一种仪器是_______ (填字母)。
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是_______ 。
(3)粗盐提纯后的精盐含有氯化钙、氯化镁、硫酸钠等可溶性杂质,常通过加入化学试剂使其转化为沉淀而除去。
a.除去氯化镁加入的试剂是_______ ,反应的化学方程式是_______ 。
b.除去硫酸钠加入的试剂是_______ ,反应的化学方程式是_______ 。
c.在滤液中加盐酸的作用是_______ 、_______ (用离子方程式表示)。

(1)操作①中必须用到的一种仪器是
A.研钵 B.量筒 C.烧杯 D.试管
(2)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是
(3)粗盐提纯后的精盐含有氯化钙、氯化镁、硫酸钠等可溶性杂质,常通过加入化学试剂使其转化为沉淀而除去。
a.除去氯化镁加入的试剂是
b.除去硫酸钠加入的试剂是
c.在滤液中加盐酸的作用是
更新时间:2021-04-12 11:56:55
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀盐酸。
已知:NaCl在乙醇中的溶解度小于其在水中的溶解度。
(1)①欲除去溶液I中的Ca2+、Mg2+、Fe3+、 离子,选出a所代表的试剂,按滴加顺序依次为
离子,选出a所代表的试剂,按滴加顺序依次为___________ (只填化学式);如何判断 已除尽?
已除尽?___________ 。
②洗涤除去NaCl晶体表面附带的KCl,选用的试剂为___________ 。
(2)①用提纯的NaCl配制250mL 2.00mol·L-1NaCl溶液,所用仪器除天平、烧杯、药匙、玻璃棒外还有________________ (填仪器名称);
②配制该溶液时,若出现以下情况,会导致溶质的物质的量浓度偏低的是___________ (填序号)
a.洗净的容量瓶未烘干
b.溶液转移至容量瓶中后没有洗涤烧杯
c.定容时俯视刻度线
d.发现凹液面超过了刻度线,随即将多余的溶液吸出
 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀盐酸。
已知:NaCl在乙醇中的溶解度小于其在水中的溶解度。
(1)①欲除去溶液I中的Ca2+、Mg2+、Fe3+、
 离子,选出a所代表的试剂,按滴加顺序依次为
离子,选出a所代表的试剂,按滴加顺序依次为 已除尽?
已除尽?②洗涤除去NaCl晶体表面附带的KCl,选用的试剂为
(2)①用提纯的NaCl配制250mL 2.00mol·L-1NaCl溶液,所用仪器除天平、烧杯、药匙、玻璃棒外还有
②配制该溶液时,若出现以下情况,会导致溶质的物质的量浓度偏低的是
a.洗净的容量瓶未烘干
b.溶液转移至容量瓶中后没有洗涤烧杯
c.定容时俯视刻度线
d.发现凹液面超过了刻度线,随即将多余的溶液吸出
您最近一年使用:0次
【推荐2】食盐是日常生活的必需品,也是重要的化工原料。
I.海水中含有大量的NaCl,以及少量的 、
、 、
、 等离子。
等离子。
(1)①为得到纯净的饱和NaCl溶液,进行了如下操作,请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量氢氧化钡溶液,过滤;
c.向滤液中加入过量_______ 溶液,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
②步骤b中反应的离子方程式是_______ 。
(2)加入足量的稀盐酸的目的是:_______ 。
II.某透明溶液中可能大量存在 、
、 、
、 、
、 、
、 中的几种离子。
中的几种离子。
(3)取少量原溶液,向其中加入过量NaOH溶液,有白色沉淀生成,迅速变为灰绿色,最后变成红褐色,说明原溶液中肯定存在的离子是_______ ,有关反应的离子方程式为_______ 、_______ 。
(4)检验原溶液中是否存在 的实验方法是
的实验方法是_______ 。
I.海水中含有大量的NaCl,以及少量的
 、
、 、
、 等离子。
等离子。(1)①为得到纯净的饱和NaCl溶液,进行了如下操作,请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量氢氧化钡溶液,过滤;
c.向滤液中加入过量
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
②步骤b中反应的离子方程式是
(2)加入足量的稀盐酸的目的是:
II.某透明溶液中可能大量存在
 、
、 、
、 、
、 、
、 中的几种离子。
中的几种离子。(3)取少量原溶液,向其中加入过量NaOH溶液,有白色沉淀生成,迅速变为灰绿色,最后变成红褐色,说明原溶液中肯定存在的离子是
(4)检验原溶液中是否存在
 的实验方法是
的实验方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
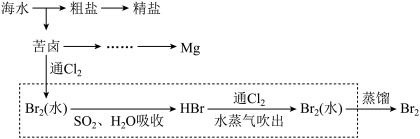
【推荐1】我国地大物博,资源非常丰富,从海水资源获取某些物质的流程示意图如下。
①生活中用氯化钠腌渍食物,食盐的作用是_______ (填字母序号)。
a.着色剂 b.防腐剂 c.膨松剂 d.营养强化剂
②粗盐中还含有泥沙、CaCl2、MgCl2以及可溶性硫酸盐等杂质,可以依次通过溶解、过滤、_______ (选填字母序号;所加试剂均过量)、结晶等一系列流程得到精盐。
a.加入Na2CO3溶液→加入NaOH溶液→加入BaCl2溶液→过滤→加入稀盐酸
b.加入NaOH溶液→加入BaCl2溶液→加入Na2CO3溶液→加入稀盐酸→过滤
c.加入BaCl2溶液→加入Na2CO3溶液→加入NaOH溶液→过滤→加入稀盐酸
③检验精盐中硫酸根是否除尽的方法是_______ (简述操作、现象及结论)。
④得到的精盐可用于冶炼金属钠,该反应的化学方程式是_______ 。
(2)工业上常用的一种海水提溴技术称为“吹出法“。
①图中虚线框内流程的主要目的是_______ 。
②图中虚线框内流程也可用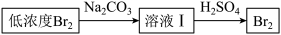 替代,请写出Br2与Na2CO3反应的化学方程式
替代,请写出Br2与Na2CO3反应的化学方程式_______ 。
(3)已知苦卤的主要成分如下:
理论上,1L苦卤最多可得到Mg(OH)2的质量为_______ g。
①生活中用氯化钠腌渍食物,食盐的作用是
a.着色剂 b.防腐剂 c.膨松剂 d.营养强化剂
②粗盐中还含有泥沙、CaCl2、MgCl2以及可溶性硫酸盐等杂质,可以依次通过溶解、过滤、
a.加入Na2CO3溶液→加入NaOH溶液→加入BaCl2溶液→过滤→加入稀盐酸
b.加入NaOH溶液→加入BaCl2溶液→加入Na2CO3溶液→加入稀盐酸→过滤
c.加入BaCl2溶液→加入Na2CO3溶液→加入NaOH溶液→过滤→加入稀盐酸
③检验精盐中硫酸根是否除尽的方法是
④得到的精盐可用于冶炼金属钠,该反应的化学方程式是
(2)工业上常用的一种海水提溴技术称为“吹出法“。
①图中虚线框内流程的主要目的是
②图中虚线框内流程也可用
 替代,请写出Br2与Na2CO3反应的化学方程式
替代,请写出Br2与Na2CO3反应的化学方程式(3)已知苦卤的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
您最近一年使用:0次
【推荐2】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:

(1)写出上述实验过程中所用试剂:试剂①___________ ;试剂③___________ 。
(2)判断试剂①已过量的方法是:___________ 。
(3)用化学方程式表示加入试剂②的作用:___________ 。
(4)操作①是利用半透膜进行分离提纯,操作①的实验结果:淀粉___________ (填“能”或“不能”,下同)透过半透膜;SO
___________ 透过半透膜。

(1)写出上述实验过程中所用试剂:试剂①
(2)判断试剂①已过量的方法是:
(3)用化学方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯,操作①的实验结果:淀粉

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】卤块的主要成分是MgCl2(还含有少量Fe2+、Fe3+、Mn2+等离子)。以它为原料按下图流程可制得单质镁。
请回答下列问题:
(1)步骤①中加入NaClO的目的是_______ ;为了尽量除去杂质,pH应调至_______ ,固体a中的成分有_______ 。
(2)溶液b中的主要溶质为_______ ,步骤②后检验固体b已洗涤干净的操作为_______ 。
(3)步骤④选用的试剂X应是_______ 。
(4)步骤⑤操作Ⅰ包括:先制得MgCl2·6H2O,再加热失水得无水MgCl2.由溶液c制MgCl2·6H2O的操作为_______ 、_______ 、过滤。
(5)步骤⑥反应的化学方程式为_______ 。
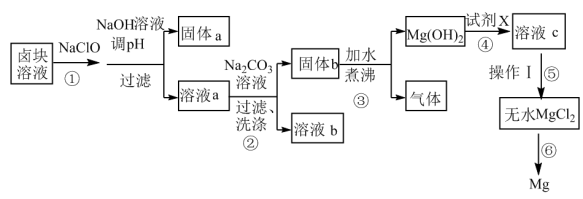
| 物质 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 8.3 | 9.6 |
| 完全沉淀 | 3.7 | 9.8 | 11.1 |
(1)步骤①中加入NaClO的目的是
(2)溶液b中的主要溶质为
(3)步骤④选用的试剂X应是
(4)步骤⑤操作Ⅰ包括:先制得MgCl2·6H2O,再加热失水得无水MgCl2.由溶液c制MgCl2·6H2O的操作为
(5)步骤⑥反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】亚氯酸钠(NaClO2)是一种高效氧化、杀菌及漂白剂,其生产工艺如下:

(1)过程Ⅰ在生成ClO2的同时,还会得到另一种常见的盐,请写出其化学方程式:________ 。
(2)过程Ⅰ中常伴有少量Cl2生成。结合下表,设计实验方案除去ClO2中的Cl2:________ 。
(3)过程Ⅱ中H2O2的作用是________ 。(填“氧化剂”或“还原剂”)写出这一过程的化学方程式:________
(4)理论上每生成1mol NaClO2,消耗SO2的物质的量是________ 。
(5)已知:ⅰ.压强越大,物质的沸点越高。
ⅱ. NaClO2饱和溶液在温度低于38℃时析出NaClO2∙3H2O,38~60℃时析出NaClO2晶体,高于60℃时分解成NaClO3和NaCl
①过程Ⅲ采用“减压蒸发”操作的原因是________ 。
②补充完整过程Ⅲ的操作:________ ,结晶后过滤,可得NaClO2粗产品。

(1)过程Ⅰ在生成ClO2的同时,还会得到另一种常见的盐,请写出其化学方程式:
(2)过程Ⅰ中常伴有少量Cl2生成。结合下表,设计实验方案除去ClO2中的Cl2:
| ClO2 | Cl2 | |
| 在水中的溶解性 | 易溶 | 溶 |
| 在CCl4中的溶解性 | 难溶 | 溶 |
(3)过程Ⅱ中H2O2的作用是
(4)理论上每生成1mol NaClO2,消耗SO2的物质的量是
(5)已知:ⅰ.压强越大,物质的沸点越高。
ⅱ. NaClO2饱和溶液在温度低于38℃时析出NaClO2∙3H2O,38~60℃时析出NaClO2晶体,高于60℃时分解成NaClO3和NaCl
①过程Ⅲ采用“减压蒸发”操作的原因是
②补充完整过程Ⅲ的操作:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
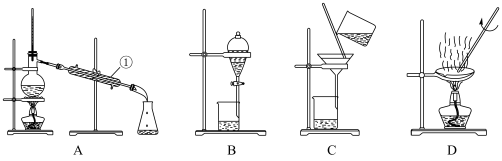
(1)从氯化钾溶液中得到氯化钾固体,选择装置____________ (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置____________ 。
(2)从碘水中分离出I2,选择装置_________ ,该分离方法的名称为___________ 。
(3)装置A中①的水的进出方向是_________ ,A中所有玻璃仪器的名称分别是__________ 。
Ⅱ.对于混合物的分离或提纯,常采用的方法有:A、分液 B、过滤 C、萃取 D、蒸馏 E、结晶 F、加热分解,下列各组物质的分离或提纯,应选用上述方法的哪一种?(填字母序号)
(4)除去Ca(OH)2溶液中悬浮的CaCO3__________ ;
(5)分离植物油和水__________ ;
(6)除去NaCl中所含的少量KNO3___________ ;
(7)除去CaO中少量CaCO3__________ ;
(8)用食用酒精浸泡中草药提取其中的有效成份_________ ;
(9)回收碘的CCl4溶液中的CCl4__________ 。

(1)从氯化钾溶液中得到氯化钾固体,选择装置
(2)从碘水中分离出I2,选择装置
(3)装置A中①的水的进出方向是
Ⅱ.对于混合物的分离或提纯,常采用的方法有:A、分液 B、过滤 C、萃取 D、蒸馏 E、结晶 F、加热分解,下列各组物质的分离或提纯,应选用上述方法的哪一种?(填字母序号)
(4)除去Ca(OH)2溶液中悬浮的CaCO3
(5)分离植物油和水
(6)除去NaCl中所含的少量KNO3
(7)除去CaO中少量CaCO3
(8)用食用酒精浸泡中草药提取其中的有效成份
(9)回收碘的CCl4溶液中的CCl4
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·6H2O):
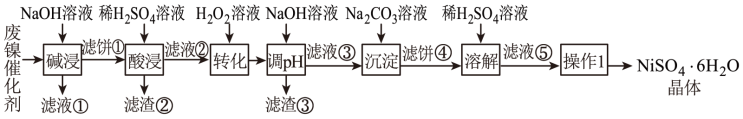
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是①溶解铝及其氧化物,②_______ 。
(2)“转化”过程中反应的离子方程式为_______ ,c(H2O2)随时间t的变化关系如图所示,反应开始10~20min内c(H2O2)迅速减小,原因可能是_______ (不考虑溶液温度变化)。

(3)利用上述表格数据,计算Ni(OH)2的Ksp=_______ 。如果“转化”后的溶液中Ni2+浓度为1.0mol·L−1,则“调pH”应控制的pH范围是_______ 。
(4)硫酸镍结晶水合物的形态与温度的关系如下表。
从滤液⑤中获得稳定NiSO4·6H2O晶体的操作1依次是蒸发浓缩、_______ 、过滤、洗涤、干燥。
(5)分离出NiSO4·6H2O晶体后的剩余液体要循环使用,则应该回流到流程中滤液_______ 的位置(填②、③、⑤),其目的是_______ 。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol·L−1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10−5mol·L−1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是①溶解铝及其氧化物,②
(2)“转化”过程中反应的离子方程式为

(3)利用上述表格数据,计算Ni(OH)2的Ksp=
(4)硫酸镍结晶水合物的形态与温度的关系如下表。
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 | NiSO4·7H2O | NiSO4·6H2O | 多种结晶水合物 | NiSO4 |
从滤液⑤中获得稳定NiSO4·6H2O晶体的操作1依次是蒸发浓缩、
(5)分离出NiSO4·6H2O晶体后的剩余液体要循环使用,则应该回流到流程中滤液
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】某工业废水(含 、
、 、
、 、
、 、
、 ),从该废水中回收利用Al和
),从该废水中回收利用Al和 的流程图如下图所示:
的流程图如下图所示:

(1)在操作a用到的玻璃仪器有烧杯、______ 、_______ 。操作c为_______ 、_______ 、过滤、洗涤。
(2)固体X、固体Y分别为_______ 、_______ (填化学式)。
(3)沉淀①在空气中充分灼烧,所得固体为_______ (填名称)。
(4)向溶液②中加入 溶液,可观察到有无色气体和白色沉淀生成,其反应的离子方程式为
溶液,可观察到有无色气体和白色沉淀生成,其反应的离子方程式为_______ 。
(5)固体X电解时若转移4 电子,可得到
电子,可得到_______ gAl。
(6)溶液③转化成溶液④主要反应的离子方程式是_______ 。
 、
、 、
、 、
、 、
、 ),从该废水中回收利用Al和
),从该废水中回收利用Al和 的流程图如下图所示:
的流程图如下图所示:
(1)在操作a用到的玻璃仪器有烧杯、
(2)固体X、固体Y分别为
(3)沉淀①在空气中充分灼烧,所得固体为
(4)向溶液②中加入
 溶液,可观察到有无色气体和白色沉淀生成,其反应的离子方程式为
溶液,可观察到有无色气体和白色沉淀生成,其反应的离子方程式为(5)固体X电解时若转移4
 电子,可得到
电子,可得到(6)溶液③转化成溶液④主要反应的离子方程式是
您最近一年使用:0次
【推荐2】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
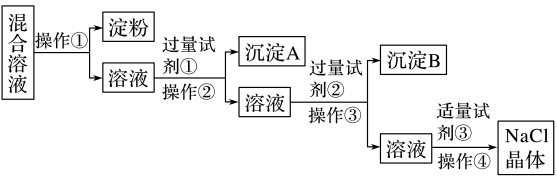
(1)写出上述实验过程中所用试剂(写化学式):试剂①_______ ;试剂③_______ 。
(2)判断试剂①已过量的方法是_______ 。
(3)用离子方程式表示加入试剂②的作用:_______ 。
(4)操作①是利用半透膜进行分离提纯。操作①的实验结果:淀粉_______ (填“能”或“不能”)透过半透膜;SO
_______ (填“能”或“不能”)透过半透膜。请用实验证明上述结果,完成下表(可不填满,也可增加)。限选试剂:1 mol·L-1 AgNO3溶液、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸

(1)写出上述实验过程中所用试剂(写化学式):试剂①
(2)判断试剂①已过量的方法是
(3)用离子方程式表示加入试剂②的作用:
(4)操作①是利用半透膜进行分离提纯。操作①的实验结果:淀粉

| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如图所示的方案对废液进行处理,以回收金属,保护环境。
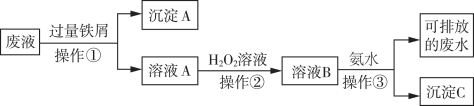
(1)操作①的名称是___________ 。加入铁屑先发生的离子反应为:________
(2)沉淀A中含有的金属单质有___________ 。
(3)操作②中观察到的实验现象是___________ 。
(4)检验溶液B中含有的金属阳离子常用的试剂是____________ 。
(5)操作③中发生反应的离子方程式为__________ 。

(1)操作①的名称是
(2)沉淀A中含有的金属单质有
(3)操作②中观察到的实验现象是
(4)检验溶液B中含有的金属阳离子常用的试剂是
(5)操作③中发生反应的离子方程式为
您最近一年使用:0次