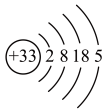
0.05 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是
| A.第二周期第VIA族 | B.第三周期第ⅡA族 |
| C.第三周期第IA族 | D.第四周期第ⅡA族 |
更新时间:2021-04-12 18:58:50
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】X元素的原子序数是9,与X元素具有相似化学性质的元素的原子序数是
| A.1 | B.8 | C.16 | D.17 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】根据中学化学教材所附元素周期表判断,下列叙述错误的是
| A.K层电子数为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子数为奇数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子数为偶数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子数为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】X、Y、Z、W为短周期元素,X原子的质子数等于Z与Y的质子数之和;Z与Y位于同一周期;Y2常用做保护气,一般由分馏液态空气得到;非金属Z的一种固体单质可导电;W原子半径是短周期元素中最大的。下列说法正确的是
| A.四种元素中简单离子半径由大到小的顺序W、X、Y、Z |
| B.X、Z、W的最高价氧化物的水化物可两两发生反应 |
| C.氢化物沸点最高的是Z的氢化物 |
| D.随着温度升高,Y2的化学活性增强,可能与W单质发生化学反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】对如图示信息的分析正确的是( )
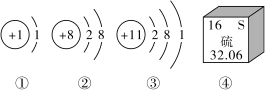

| A.图①②对应元素形成的化合物只有一种 |
| B.图③④对应元素的离子核外电子排布相同 |
| C.图①③对应元素的化学性质不相似 |
| D.图①②④对应的三种元素形成的化合物水溶液pH>7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的核外电子数之和与X、W原子的核外电子数之和的比为5:4。下列说法不正确的是( )
A.原子半径: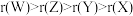 |
| B.Y的简单气态氢化物与Z的单质在一定条件下可生成Y单质 |
| C.Y的最高价氧化物对应水化物的浓溶液受热易分解 |
| D.由X、Y、Z三种元素组成的碱受热易分解 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】(YW4)2X2Z4•W2Z为无色柱状晶体,受热易分解,已知W、X、Y、Z的原子序数依次增大,其和为22,X、Y、Z为同一周期相邻元素。可利用如图装置检验该化合物分解出的相同元素组成的不同产物:

| A.(YW4)2X2Z4•W2Z可以与碱溶液反应 |
| B.装置B中盛装的试剂是氢氧化钠溶液 |
| C.反应开始前通入Y2,可以避免装置中的空气干扰产物的检验 |
| D.装置中两处澄清石灰水都变浑浊,证明分解产物中含有两种由X、Z组成的物质 |
您最近一年使用:0次