实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(带砝码、最小砝码为5 g)、药匙、烧杯、_____ 、_____ 、____ 以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体____ g。
(3)称量。
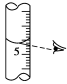
①天平调平之后,应将天平的游码调至某个位置,请在图中用一根竖线标出游码左边缘所处的位置:________
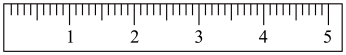
②称量过程中NaCl晶体应放于天平的____ (填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是___ 。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了______ 。
(6)定容。向容量瓶中加水至液面接近刻度线____ 处,改用胶头滴管加水,使溶液凹液面与刻度线相切。
(7)摇匀、装瓶。
(8)某学生配制了100 mL 1 mol·L-1的硫酸,然后对溶液浓度做精确测定,且测定过程中一切操作都正确,但测得溶液的物质的量浓度小于1 mol·L-1。则在配制过程中,下列操作可能导致溶液浓度偏低的是_______ 。
①量筒用蒸馏水洗净后立即用来量取浓硫酸
②定容时仰视刻度线
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度线,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(带砝码、最小砝码为5 g)、药匙、烧杯、
(2)计算。配制该溶液需取NaCl晶体
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在图中用一根竖线标出游码左边缘所处的位置:

②称量过程中NaCl晶体应放于天平的
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了
(6)定容。向容量瓶中加水至液面接近刻度线
(7)摇匀、装瓶。
(8)某学生配制了100 mL 1 mol·L-1的硫酸,然后对溶液浓度做精确测定,且测定过程中一切操作都正确,但测得溶液的物质的量浓度小于1 mol·L-1。则在配制过程中,下列操作可能导致溶液浓度偏低的是
①量筒用蒸馏水洗净后立即用来量取浓硫酸
②定容时仰视刻度线
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度线,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切
更新时间:2021-05-19 06:13:53
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】实验室需要0.3 mol/L NaOH溶液480 mL和1.0 mol/L硫酸溶液250 mL。根据这两种溶液的配制情况回答下列问题。
(1)如图所示的仪器中配制溶液肯定不需要的是___________ (填序号),配制上述溶液还需用到的玻璃仪器是___________ (填仪器名称)。

(2)下列操作中,容量瓶所不具备的功能有___________ (填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为___________ g。在实验中其它操作均正确,若定容时仰视刻度线,则所得溶液浓度___________ 0.3 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___________ 0.3 mol/L。
(4)某学生使用托盘天平称食盐时,错误的将食盐放在右托盘,而把砝码放在左托盘,称得食盐的质量为15.5g(1g以下只能使用游码)。如果按正确的放法,食盐的质量应为___________
(5)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为___________ mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用___________ mL的量筒最好
(1)如图所示的仪器中配制溶液肯定不需要的是

(2)下列操作中,容量瓶所不具备的功能有
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为
(4)某学生使用托盘天平称食盐时,错误的将食盐放在右托盘,而把砝码放在左托盘,称得食盐的质量为15.5g(1g以下只能使用游码)。如果按正确的放法,食盐的质量应为
(5)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】分析化学中的滴定法除了酸碱中和滴定,还有沉淀滴定、络合滴定、氧化还原滴定等。沉淀滴定法可用于NaCl溶液中 的测定。实验过程包括准备标准溶液和滴定待测溶液。已知:
的测定。实验过程包括准备标准溶液和滴定待测溶液。已知:
① 是一种难溶于水的砖红色沉淀;
是一种难溶于水的砖红色沉淀;
②溶液中同时存在 和
和 时,滴入
时,滴入 溶液,先生成AgCl沉淀;
溶液,先生成AgCl沉淀;
③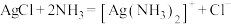 。
。
I.准备标准溶液
准确称取 基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
II.滴定待测溶液
a.取待测NaCl溶液25.00mL于锥形瓶中。
b.加入1mL5% 溶液。
溶液。
c.边不断晃动锥形瓶边用 标准溶液滴定,当接近终点时,半滴半滴地滴入
标准溶液滴定,当接近终点时,半滴半滴地滴入 溶液,并用力摇晃。记下达终点时消耗
溶液,并用力摇晃。记下达终点时消耗 标准溶液的体积。
标准溶液的体积。
d.重复上述操作两次。三次测定数据如下表。
e.数据处理。
回答下列问题:
(1)将称得的 配制成标准溶液。所使用的仪器除烧杯和玻璃棒外还有
配制成标准溶液。所使用的仪器除烧杯和玻璃棒外还有___________ 。
(2)滴定终点的现象是_________ 。
(3)计算所消耗的 标准溶液平均体积为
标准溶液平均体积为______ mL,测得
____  。
。
(4)若用该方法测定 溶液中的
溶液中的 ,待测液的pH不宜超过7.2,理由是
,待测液的pH不宜超过7.2,理由是________ 。
(5)下列关于实验的说法合理的是___________。
 的测定。实验过程包括准备标准溶液和滴定待测溶液。已知:
的测定。实验过程包括准备标准溶液和滴定待测溶液。已知:①
 是一种难溶于水的砖红色沉淀;
是一种难溶于水的砖红色沉淀;②溶液中同时存在
 和
和 时,滴入
时,滴入 溶液,先生成AgCl沉淀;
溶液,先生成AgCl沉淀;③
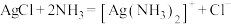 。
。I.准备标准溶液
准确称取
 基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。II.滴定待测溶液
a.取待测NaCl溶液25.00mL于锥形瓶中。
b.加入1mL5%
 溶液。
溶液。c.边不断晃动锥形瓶边用
 标准溶液滴定,当接近终点时,半滴半滴地滴入
标准溶液滴定,当接近终点时,半滴半滴地滴入 溶液,并用力摇晃。记下达终点时消耗
溶液,并用力摇晃。记下达终点时消耗 标准溶液的体积。
标准溶液的体积。d.重复上述操作两次。三次测定数据如下表。
| 实验序号 | 1 | 2 | 3 |
消耗 标准溶液体积/mL 标准溶液体积/mL | 20.45 | 20.02 | 19.98 |
回答下列问题:
(1)将称得的
 配制成标准溶液。所使用的仪器除烧杯和玻璃棒外还有
配制成标准溶液。所使用的仪器除烧杯和玻璃棒外还有(2)滴定终点的现象是
(3)计算所消耗的
 标准溶液平均体积为
标准溶液平均体积为
 。
。(4)若用该方法测定
 溶液中的
溶液中的 ,待测液的pH不宜超过7.2,理由是
,待测液的pH不宜超过7.2,理由是(5)下列关于实验的说法合理的是___________。
A.为使终点现象更加明显,可改加1mL10% 溶液 溶液 |
| B.滴定过程中可用蒸馏水将锥形瓶壁上黏附的溶液冲下 |
C.若在配制 标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高 标准溶液时,烧杯中的溶液有少量溅出,则测定结果偏高 |
| D.若未等滴定管液面稳定就读数会导致测定结果偏高 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】欲用98%的浓硫酸(ρ=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________ ,②烧 杯 , ③玻璃棒, ④量筒, ⑤____________ 。
(2)请将下列各操作,按正确的序号填在横线上(所用仪器均干净、干燥)。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀 C.用胶头滴管加蒸馏至刻度线 D.洗涤稀释仪器 E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________ 。
(3)简要回答下列问题:
①所需量取浓硫酸的体积为____________ mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________ mL的量筒最好,若量取时发现量筒不干净,用水洗净后直接量取,将使溶液浓度__________ ;(“偏高”、“偏低”、“无影响”)
③在转入容量瓶前烧杯中液体应_________ ,否则会使浓度偏____________ ;
④定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________ ;
(1)选用的主要仪器有:
①
(2)请将下列各操作,按正确的序号填在横线上(所用仪器均干净、干燥)。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀 C.用胶头滴管加蒸馏至刻度线 D.洗涤稀释仪器 E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为
(3)简要回答下列问题:
①所需量取浓硫酸的体积为
②如果实验室有15mL、20mL、50mL的量筒应选用
③在转入容量瓶前烧杯中液体应
④定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】右图为实验室某浓盐酸试剂瓶上的标签,回答下列问题

(1)该浓盐酸中HCl的物质的量浓度为__________ mol/L。
(2)配制240mL 0.3mol/L的盐酸溶液
A.用________ mL量筒量取所需的浓盐酸的体积__________ mL,沿玻璃棒倒入烧杯中,再加入蒸馏水,用玻璃棒慢慢搅动,使其混合均匀。
B.将已冷却的盐酸沿玻璃棒注入___________ mL容量瓶中。
C.用蒸馏水洗涤___________________________ 2—3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内加水直到液面接近刻度线1-2cm处,改用_________ 加水,使溶液凹面恰好与刻度相切。
E.将容量瓶盖紧,振荡,摇匀。
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水______________ ;
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,则浓度______________ ;
③定容时俯视容量瓶刻度线__________________ 。
④洗涤量取浓盐酸后的量筒,并将洗涤液转移到容量瓶中__________________ 。
(4)某同学用Na2CO3配制50 mL 1.0 mol/L的Na2CO3溶液的过程如图所示:
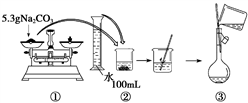

你认为该同学的错误步骤有______________ 。(填序号)

(1)该浓盐酸中HCl的物质的量浓度为
(2)配制240mL 0.3mol/L的盐酸溶液
A.用
B.将已冷却的盐酸沿玻璃棒注入
C.用蒸馏水洗涤
D.继续往容量瓶内加水直到液面接近刻度线1-2cm处,改用
E.将容量瓶盖紧,振荡,摇匀。
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,则浓度
③定容时俯视容量瓶刻度线
④洗涤量取浓盐酸后的量筒,并将洗涤液转移到容量瓶中
(4)某同学用Na2CO3配制50 mL 1.0 mol/L的Na2CO3溶液的过程如图所示:


你认为该同学的错误步骤有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】“84”消毒液是一种常见的含氯消毒剂,请回答下列问题:
(1)某“84”消毒液部分标签如下图所示
①计算该“84”消毒液中NaClO的物质的量浓度为_______ mol/L(保留小数点后一位)。
②若用NaClO固体配制相同物质的量浓度的NaClO溶液,下列操作可能使溶液浓度偏高的是_______ (填标号)。
A.容量瓶用蒸馏水洗净后,没干燥就直接使用 B.定容摇匀后,液面低于刻度线
C.未洗涤烧杯内壁和玻璃棒 D.定容时,俯视容量瓶刻度线
(2)实验小组欲利用 与NaOH溶液反应制备“84”消毒液,选择实验装置如下:
与NaOH溶液反应制备“84”消毒液,选择实验装置如下:

①B中发生反应的离子方程式为_______ 。
②C中盛装试剂为_______ ,D的作用是_______ 。
③仪器的连接顺序为a→_______ (按气流方向,用小写字母表示)。
(3)“84”消毒液需要避光密封保存,否则容易变质而失效,用化学方程式解释其原因:
① ;
;
②_______ 。
(4)若要制得题(1)标签所示的84消毒液,理论上需要_______ g的 。
。
(1)某“84”消毒液部分标签如下图所示
| 84消毒液 有效成分NaClO 规格1000mL NaClO质量分数25% 密度1.2  |
②若用NaClO固体配制相同物质的量浓度的NaClO溶液,下列操作可能使溶液浓度偏高的是
A.容量瓶用蒸馏水洗净后,没干燥就直接使用 B.定容摇匀后,液面低于刻度线
C.未洗涤烧杯内壁和玻璃棒 D.定容时,俯视容量瓶刻度线
(2)实验小组欲利用
 与NaOH溶液反应制备“84”消毒液,选择实验装置如下:
与NaOH溶液反应制备“84”消毒液,选择实验装置如下:
①B中发生反应的离子方程式为
②C中盛装试剂为
③仪器的连接顺序为a→
(3)“84”消毒液需要避光密封保存,否则容易变质而失效,用化学方程式解释其原因:
①
 ;
;②
(4)若要制得题(1)标签所示的84消毒液,理论上需要
 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】下图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为______ mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是______ (填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取__ mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、50mL量筒,应选用____ mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将___ (偏高、偏低、无影响)。
②配制时所需仪器除了量筒外,还需要的仪器有:_________ 。
③下列情况会导致所配溶液的浓度偏低的是__________ (填字母代号)。
A.浓盐酸挥发,浓度不足 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
盐酸 分子式:HCl 相对分子质量:36.5 密度:1.2g/mL HCl的质量分数:36.5% |
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取
②配制时所需仪器除了量筒外,还需要的仪器有:
③下列情况会导致所配溶液的浓度偏低的是
A.浓盐酸挥发,浓度不足 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室欲配制 240mL 0.2 mol·L-1 的碳酸钠溶液,回答下列问题:
(1)通过计算可知,应用托盘天平称取______ g Na2CO3 固体。
(2)配制过程必需的仪器有: 胶头滴管、托盘天平、药匙、烧杯、玻璃棒,还缺少的仪器是______ 。
(3)在配制过程中,下列操作中会引起误差且使浓度偏小的是___ (填序号)。
①没有洗涤烧杯和玻璃棒 ② 容量瓶不干燥,含有少量蒸馏水
③未冷却到室温就将溶液转移到容量瓶并定容 ④定容时仰视刻度线
(1)通过计算可知,应用托盘天平称取
(2)配制过程必需的仪器有: 胶头滴管、托盘天平、药匙、烧杯、玻璃棒,还缺少的仪器是
(3)在配制过程中,下列操作中会引起误差且使浓度偏小的是
①没有洗涤烧杯和玻璃棒 ② 容量瓶不干燥,含有少量蒸馏水
③未冷却到室温就将溶液转移到容量瓶并定容 ④定容时仰视刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】用18.4 mol·L-1的浓硫酸,配制100 mL 1.0 mol·L-1的稀硫酸,请回答以下问题:
(1)需要18.4 mol·L-1的浓硫酸__________ mL;
(2)配制时不需要用到的仪器有__________ (填仪器的标号);
A.托盘天平 B.烧杯 C.量筒 D.烧瓶 E.250 mL容量瓶 F.100 mL容量瓶 G.胶头滴管 H.铁架台(带铁夹) I.玻璃棒
(3)下列实验步骤中,正确的操作顺序应该是__________ 。
A.用量筒量取浓硫酸后,缓缓倒入装有约50 mL 蒸馏水的烧杯里,并用玻璃棒搅拌
B.用约30 mL蒸馏水,分三次洗涤烧杯和玻璃棒,将每次的洗涤液都倒入容量瓶中
C.将稀释后的硫酸小心地倒入容量瓶中
D.检查100 mL容量瓶瓶口是否有漏液现象
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1~2 cm处
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切
(4)进行A步操作的时候,应该选用__________ mL量筒。如果对装有浓硫酸的量筒读数如图所示,配制的稀硫酸的浓度将__________ (填“偏高”“偏低”或“无影响”)。
(5)进行A步操作后,必须_________ 后,才能进行C步操作。
(1)需要18.4 mol·L-1的浓硫酸
(2)配制时不需要用到的仪器有
A.托盘天平 B.烧杯 C.量筒 D.烧瓶 E.250 mL容量瓶 F.100 mL容量瓶 G.胶头滴管 H.铁架台(带铁夹) I.玻璃棒
(3)下列实验步骤中,正确的操作顺序应该是
A.用量筒量取浓硫酸后,缓缓倒入装有约50 mL 蒸馏水的烧杯里,并用玻璃棒搅拌
B.用约30 mL蒸馏水,分三次洗涤烧杯和玻璃棒,将每次的洗涤液都倒入容量瓶中
C.将稀释后的硫酸小心地倒入容量瓶中
D.检查100 mL容量瓶瓶口是否有漏液现象
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1~2 cm处
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切
(4)进行A步操作的时候,应该选用

(5)进行A步操作后,必须
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】配制500 mL0.5mol/LNaOH溶液,试回答下列问题:
(1)需要称取NaOH固体的质量为___ ;
(2)配制方法:设计五个操作步骤,请在横线上填上合适的仪器名称
①向盛有NaOH的烧杯中加入100mL蒸馏水使其溶解,并冷却至室温。
②将NaOH溶液沿___ 注入___ 中。
③在烧杯中加入少量的蒸馏水,小心洗涤___ 2~3次并把每次的洗涤液都转移入___ 。
④继续往___ 中加蒸馏水至液面接近刻度线1~2cm。
⑤改用___ 滴加蒸馏水至刻度线,盖好摇匀。
(3)以下操作会使实际配制NaOH溶液的浓度偏低的有___ 。
A.定容时俯视刻度线 B.溶解后的烧杯未经洗涤
C.称量用的烧杯不干燥 D.容量瓶中原来存有少量蒸馏水
(1)需要称取NaOH固体的质量为
(2)配制方法:设计五个操作步骤,请在横线上填上合适的仪器名称
①向盛有NaOH的烧杯中加入100mL蒸馏水使其溶解,并冷却至室温。
②将NaOH溶液沿
③在烧杯中加入少量的蒸馏水,小心洗涤
④继续往
⑤改用
(3)以下操作会使实际配制NaOH溶液的浓度偏低的有
A.定容时俯视刻度线 B.溶解后的烧杯未经洗涤
C.称量用的烧杯不干燥 D.容量瓶中原来存有少量蒸馏水
您最近一年使用:0次



