研究化学反应中的能量变化,有助于人们更好地利用化学反应为生产和生活服务。
(1)用Cl2生产某些含氯有机物时会产生副产物HCl,利用下列反应可实现氯的循环利用:
已知:a.上述反应中,4 mol HCl被氧化,放出115.6 kJ的热量;
b.





①H2O的电子式为___________ 。
②断开1 mol 键与断开1 mol
键与断开1 mol 键所需能量相差约为
键所需能量相差约为___________ kJ,H2O中 键比HCl中
键比HCl中 键
键___________ (填“强”或“弱”)。
(2)我国“神舟”系列飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。飞船在光照区运行时,太阳能电池帆板将___________ 能转化为___________ 能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。
(3)科学家已研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术: 。制得的氢气可用于燃料电池。
。制得的氢气可用于燃料电池。

①太阳光分解海水过程中的能量变化如图所示,则该反应属于___________ (填“放热”或“吸热”)反应。反应过程
②某种氢氧燃料电池可用20% KOH溶液作电解质,正极反应式为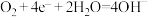 ,则电池的负极反应式为
,则电池的负极反应式为___________ 。供电过程中,当消耗氢气11.2L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移电子的物质的量为___________ mol。
(1)用Cl2生产某些含氯有机物时会产生副产物HCl,利用下列反应可实现氯的循环利用:

已知:a.上述反应中,4 mol HCl被氧化,放出115.6 kJ的热量;
b.






①H2O的电子式为
②断开1 mol
 键与断开1 mol
键与断开1 mol 键所需能量相差约为
键所需能量相差约为 键比HCl中
键比HCl中 键
键(2)我国“神舟”系列飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。飞船在光照区运行时,太阳能电池帆板将
(3)科学家已研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:
 。制得的氢气可用于燃料电池。
。制得的氢气可用于燃料电池。
①太阳光分解海水过程中的能量变化如图所示,则该反应属于
②某种氢氧燃料电池可用20% KOH溶液作电解质,正极反应式为
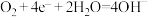 ,则电池的负极反应式为
,则电池的负极反应式为
更新时间:2021-07-10 15:12:25
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+ O2(g)===CO(g) ΔH=-111 kJ·mol−1
O2(g)===CO(g) ΔH=-111 kJ·mol−1
①该催化重整反应的ΔH=____ kJ·mol−1。有利于提高CH4平衡转化率的条件是____ (填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为______ mol2·L−2。下列可判断该反应达到平衡的是_________ (填标号)。
A.单位时间内生成n mol的CH4,同时生成n mol的H2 B.v(CH4):v(CO)=1:2
C.容器中混合气体的密度不再发生变化 D.容器中的压强保持不变
(2)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图1,则ΔH______ (填“>”、“=”或“<”)0。
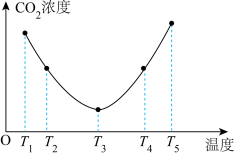

图1 图2
(3)O2辅助的Al-CO2电池工作原理如图2所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________________________________ 。
电池的正极反应式:6O2+6e-=6O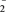 ;6CO2+6O
;6CO2+6O =3C2O42-+6O2
=3C2O42-+6O2
反应过程中O2的作用是_________________ 。
(4)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-) = 2∶1,溶液pH=________ 。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+
 O2(g)===CO(g) ΔH=-111 kJ·mol−1
O2(g)===CO(g) ΔH=-111 kJ·mol−1①该催化重整反应的ΔH=
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
A.单位时间内生成n mol的CH4,同时生成n mol的H2 B.v(CH4):v(CO)=1:2
C.容器中混合气体的密度不再发生变化 D.容器中的压强保持不变
(2)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图1,则ΔH


图1 图2
(3)O2辅助的Al-CO2电池工作原理如图2所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:
电池的正极反应式:6O2+6e-=6O
 ;6CO2+6O
;6CO2+6O =3C2O42-+6O2
=3C2O42-+6O2反应过程中O2的作用是
(4)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-) = 2∶1,溶液pH=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】丙酮蒸气热裂解可生产乙烯酮,反应为 (g) ⇌O=C=CH2(g)+CH4(g) ∆H>0,现对该热裂解反应进行研究,回答下列问题:
(g) ⇌O=C=CH2(g)+CH4(g) ∆H>0,现对该热裂解反应进行研究,回答下列问题:
(1)①根据表格中的键能数据,计算ΔH=__ kJ·mol-1;
②该反应在___ (填“低温”或“高温”或“任意温度”)条件下可自发进行。
(2)在恒容绝热密闭容器中,充入丙酮蒸气,可以判断下列到达平衡状态的是___ 。
A.O=C=CH2(g)消耗速率与CH4生成速率相等
B.容器内密度不再变化
C.反应的平衡常数不再变化
D.混合气体的平均相对分子质量不再变化
E.O=C=CH2(g)和CH4(g)的浓度比保持不变
(3)丙酮的平衡转化率随温度、压强变化如图所示:

①图中X表示的物理量是___ ;温度:A点___ B点(填“>”、“<”或“=”),说明判断理由___ ;
②A、C两点化学平衡常数KA___ Kc(填“>”、 “<”或“=”);
③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是___ 。
(4)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110kPa)。
①经过时间tmin,丙酮分解10%。用单位时间内气体分压变化表示的反应速率v(丙酮)___ kPa/min;
②该条件平衡时丙酮分解率为a,则Kp=__ (以分压表示,分压=总压x物质的量分数)。
 (g) ⇌O=C=CH2(g)+CH4(g) ∆H>0,现对该热裂解反应进行研究,回答下列问题:
(g) ⇌O=C=CH2(g)+CH4(g) ∆H>0,现对该热裂解反应进行研究,回答下列问题:(1)①根据表格中的键能数据,计算ΔH=
| 化学键 | C—H | C—C | C=C |
| 键能/kJ∙mol-1 | 412 | 348 | 612 |
②该反应在
(2)在恒容绝热密闭容器中,充入丙酮蒸气,可以判断下列到达平衡状态的是
A.O=C=CH2(g)消耗速率与CH4生成速率相等
B.容器内密度不再变化
C.反应的平衡常数不再变化
D.混合气体的平均相对分子质量不再变化
E.O=C=CH2(g)和CH4(g)的浓度比保持不变
(3)丙酮的平衡转化率随温度、压强变化如图所示:

①图中X表示的物理量是
②A、C两点化学平衡常数KA
③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是
(4)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110kPa)。
①经过时间tmin,丙酮分解10%。用单位时间内气体分压变化表示的反应速率v(丙酮)
②该条件平衡时丙酮分解率为a,则Kp=
您最近一年使用:0次
【推荐3】 加氢制
加氢制 是
是 资源化利用的重要途径,该过程存在如下两个反应:
资源化利用的重要途径,该过程存在如下两个反应:
反应Ⅰ: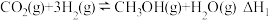
反应Ⅱ: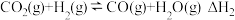
回答下列问题:
(1)根据图计算,
_______  ,
,
_______  。
。

(2)在 压强下,按
压强下,按 把两种气体通入恒压反应器中,
把两种气体通入恒压反应器中, 的平衡转化率及
的平衡转化率及 的平衡产率随温度变化关系如图所示。已知:
的平衡产率随温度变化关系如图所示。已知: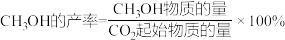

① 时,使
时,使 平衡转化率随温度升高而增大的反应为
平衡转化率随温度升高而增大的反应为_______ (填“反应Ⅰ”或“反应Ⅱ”)。
② 时,平衡体系中
时,平衡体系中
_______ ,反应Ⅰ的平衡常数
_______  (列出计算式)。
(列出计算式)。
(3)要同时提高 的平衡转化率和
的平衡转化率和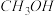 的平衡产率,除降低温度外,还可采取的措施是
的平衡产率,除降低温度外,还可采取的措施是_______ (写一条)。
(4)电解法可实现 资源化利用。电解
资源化利用。电解 制
制 的原理如图所示,写出阴极
的原理如图所示,写出阴极 还原为
还原为 的电极反应式:
的电极反应式:_______ 。

 加氢制
加氢制 是
是 资源化利用的重要途径,该过程存在如下两个反应:
资源化利用的重要途径,该过程存在如下两个反应:反应Ⅰ:
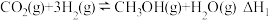
反应Ⅱ:
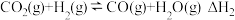
回答下列问题:
(1)根据图计算,

 ,
,
 。
。
(2)在
 压强下,按
压强下,按 把两种气体通入恒压反应器中,
把两种气体通入恒压反应器中, 的平衡转化率及
的平衡转化率及 的平衡产率随温度变化关系如图所示。已知:
的平衡产率随温度变化关系如图所示。已知: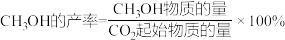

①
 时,使
时,使 平衡转化率随温度升高而增大的反应为
平衡转化率随温度升高而增大的反应为②
 时,平衡体系中
时,平衡体系中

 (列出计算式)。
(列出计算式)。(3)要同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,除降低温度外,还可采取的措施是
的平衡产率,除降低温度外,还可采取的措施是(4)电解法可实现
 资源化利用。电解
资源化利用。电解 制
制 的原理如图所示,写出阴极
的原理如图所示,写出阴极 还原为
还原为 的电极反应式:
的电极反应式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温压下有三种是气体,三种是固体。请回答下列问题:
(1)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有_______ 。
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______ 。
(3)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为_______ 。
(4)在10 L的密闭容器中,通入2 mol FC2气体和1 mol C2气体,一定条件下反应后生成FC3气体,当反应达到平衡时, C2的浓度为0.01 mol/L,则平衡时FC2的转化率为_______ 。
(1)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:
(3)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为
(4)在10 L的密闭容器中,通入2 mol FC2气体和1 mol C2气体,一定条件下反应后生成FC3气体,当反应达到平衡时, C2的浓度为0.01 mol/L,则平衡时FC2的转化率为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D四种短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素,B元素原子的最外层电子数是次外层的2倍,C是地壳中含量最多的元素,D是第三周期原子半径最小的元素,A、B两种元素组成的最简单的化合物为X。
(1)B元素在元素周期表中的位置___ 。
(2)X分子的空间结构为___ 。
(3)B与C非金属性强的元素是___ (填元素符号)。
(4)A2与C2组成的燃料电池,通入A2的一极是___ (填“正极”或“负极”),该燃料电池的优点___ (写一条即可)。
(5)写出X与D单质生成BA3D的化学方程式___ ,该反应类型为___ 。
(1)B元素在元素周期表中的位置
(2)X分子的空间结构为
(3)B与C非金属性强的元素是
(4)A2与C2组成的燃料电池,通入A2的一极是
(5)写出X与D单质生成BA3D的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题。
(1)如图为氢氧燃料电池的构造示意图。________ 口通入;电池工作时, 向
向________ 极移动。
②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质可以传导 ,则电池工作时负极电极反应式为
,则电池工作时负极电极反应式为________ 。
(2)银锌电池总反应为: 。则负极电极反应式:
。则负极电极反应式:________ 。正极电极反应式:________ 。
(3)铅酸蓄电池反应为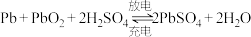 。用铅酸蓄电池电化学降解法处理酸性硝酸盐污水。
。用铅酸蓄电池电化学降解法处理酸性硝酸盐污水。
①铅酸蓄电池的负极材料________ (填“Pb”或“PbO2”)极。
②放电时负极电极反应式为:________ 。充电时的阳极反应式:________________ 。
(1)如图为氢氧燃料电池的构造示意图。
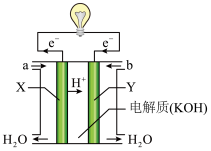
 向
向②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质可以传导
 ,则电池工作时负极电极反应式为
,则电池工作时负极电极反应式为(2)银锌电池总反应为:
 。则负极电极反应式:
。则负极电极反应式:(3)铅酸蓄电池反应为
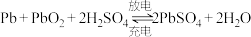 。用铅酸蓄电池电化学降解法处理酸性硝酸盐污水。
。用铅酸蓄电池电化学降解法处理酸性硝酸盐污水。①铅酸蓄电池的负极材料
②放电时负极电极反应式为:
您最近一年使用:0次



