实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。
①配制100mL 0.10mol/L NaOH标准溶液。
②取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
请完成下列问题:
(1)滴定达到终点的现象是_______ 。
(2)根据上述数据,可计算出该盐酸的浓度约为_______ (保留两位有效数字)
(3)排去碱式滴定管中气泡的方法应采用操作_______ ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ 。(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
G、滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
①配制100mL 0.10mol/L NaOH标准溶液。
②取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
(1)滴定达到终点的现象是
(2)根据上述数据,可计算出该盐酸的浓度约为
(3)排去碱式滴定管中气泡的方法应采用操作

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
G、滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
18-19高二上·新疆阿勒泰·期末 查看更多[7]
新疆阿勒泰地区2018-2019学年高二上学期期末考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)专题3.2.2 酸碱中和滴定和pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)第3章 水溶液中的离子反应与平衡(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)甘肃省张掖市高台县第一中学2022--2023学年高二上学期10月模拟考试化学试题江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题重庆市璧山来凤中学2023-2024学年高二上学期12月月考化学试题
更新时间:2021-08-25 15:33:37
|
【知识点】 酸碱中和滴定的综合考查解读
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】用中和滴定法测定某烧碱样品的纯度,请回答下列问题:
(1)准确称量5.0 g含有少量易溶杂质的样品(杂质不与盐酸反应),配成250 mL待测溶液,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、___________________ 。
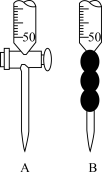
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,量取待测液10.00 mL应选用_________ 仪器(填字母)。
(3)滴定过程中,眼睛应注视___________________________________ ,以甲基橙做指示剂,正确判断滴定终点的现象是________________________________ 。
(4)由下表可知,第2次所用盐酸体积明显偏大,其可能的原因是_________ 。
a.锥形瓶用待测液润洗
b.滴定过程中锥形瓶中溶液溅出瓶外
c.滴定前滴定管尖嘴有气泡,滴定结束气泡消失
d.滴定结束时,俯视读数
(5)根据表中数据,计算被测烧碱溶液的物质的量浓度是_________ ,烧碱样品的纯度是_________ 。
(1)准确称量5.0 g含有少量易溶杂质的样品(杂质不与盐酸反应),配成250 mL待测溶液,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,量取待测液10.00 mL应选用

(3)滴定过程中,眼睛应注视
(4)由下表可知,第2次所用盐酸体积明显偏大,其可能的原因是
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 2.10 | 24.20 |
| 第三次 | 10.00 | 4.10 | 24.00 |
b.滴定过程中锥形瓶中溶液溅出瓶外
c.滴定前滴定管尖嘴有气泡,滴定结束气泡消失
d.滴定结束时,俯视读数
(5)根据表中数据,计算被测烧碱溶液的物质的量浓度是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】I.常温下,用0.1mol·L-1NaOH溶液滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到如图所示的滴定曲线:

(1)用NaOH溶液滴定醋酸溶液通常选择的指示剂为_______ 。
(2)符合NaOH溶液滴定醋酸溶液滴定曲线的是_______ (填“甲”或“乙”)。
II.某兴趣小组使用酸碱中和滴定法测定某品牌白醋中醋酸的含量,主要步骤如下:
①量取10.00mL食用白醋,稀释后准确配制100mL白醋溶液。
②配制100mL0.100mol·L-1NaOH标准溶液。
③用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴指示剂。
④进行滴定,重复滴定三次,三次消耗NaOH标准溶液的体积分别为14.95mL、15.00mL、15.05mL。
(3)配制100mL白醋溶液,所使用的玻璃仪器除量筒、烧杯和玻璃棒外,还有_______ 。
(4)滴定终点的现象是_______ 。
(5)下列操作会使测定结果偏小的是_______ (填序号)。
a.未用标准溶液润洗滴定管
b.标准溶液漏滴在锥形瓶外一滴
c.滴定前平视,滴定后俯视滴定管读数
d.待测液溅出锥形瓶外一滴
(6)该白醋中醋酸的含量为_______ mg·mL-1。

(1)用NaOH溶液滴定醋酸溶液通常选择的指示剂为
(2)符合NaOH溶液滴定醋酸溶液滴定曲线的是
II.某兴趣小组使用酸碱中和滴定法测定某品牌白醋中醋酸的含量,主要步骤如下:
①量取10.00mL食用白醋,稀释后准确配制100mL白醋溶液。
②配制100mL0.100mol·L-1NaOH标准溶液。
③用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴指示剂。
④进行滴定,重复滴定三次,三次消耗NaOH标准溶液的体积分别为14.95mL、15.00mL、15.05mL。
(3)配制100mL白醋溶液,所使用的玻璃仪器除量筒、烧杯和玻璃棒外,还有
(4)滴定终点的现象是
(5)下列操作会使测定结果偏小的是
a.未用标准溶液润洗滴定管
b.标准溶液漏滴在锥形瓶外一滴
c.滴定前平视,滴定后俯视滴定管读数
d.待测液溅出锥形瓶外一滴
(6)该白醋中醋酸的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某学生用已知物质的量浓度的盐酸测定未知物质的/量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1用标准的盐酸滴定待测的NaOH溶液时:左手_______________________ ,右手_____________________ 眼睛注视__________________________________ 直到因加入一滴盐酸后,溶液由黄色变______ 色,并且_____________________ 为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是()
A:酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B:滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C:酸式滴定管在滴定前有气泡,滴定后气泡消失
D:读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____ mL终点读数为_______ mL,所用盐酸溶液的体积为_________ mL;

(4)某学生根据3次实验分别记录有关数据如下表:
依据上表数据列式计算该NaOH溶液的物质的量浓度:__________________
(1用标准的盐酸滴定待测的NaOH溶液时:左手
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是()
A:酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B:滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C:酸式滴定管在滴定前有气泡,滴定后气泡消失
D:读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为

(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol•L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度:
您最近一年使用:0次



