分别按图甲乙所示装置进行实验,两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表。
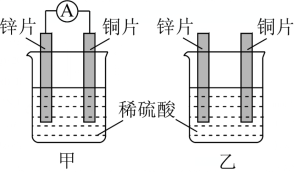
(1)下列叙述正确的是___________
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片作正极,乙中铜片作负极
C. 两烧杯溶液中 浓度均减小
浓度均减小
D. 甲产生气泡的速率比乙慢
(2)在甲装置中,若把稀硫酸换成CuSO4溶液,一段时间后测得某一电极增重12.8g,则该电池反应共转移电子数目___________
(3)甲装置中的能量转化形式为___________ 能转化为___________ 能,乙装置中的能量转化形式为___________ 能转化为___________ 能
(4)如果将反应2FeCl3+Fe=3FeCl2设计成原电池,则正极电极反应为___________ ,正极材料是___________ ,负极材料是___________ ,电解质溶液是___________ 。

(1)下列叙述正确的是
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片作正极,乙中铜片作负极
C. 两烧杯溶液中
 浓度均减小
浓度均减小D. 甲产生气泡的速率比乙慢
(2)在甲装置中,若把稀硫酸换成CuSO4溶液,一段时间后测得某一电极增重12.8g,则该电池反应共转移电子数目
(3)甲装置中的能量转化形式为
(4)如果将反应2FeCl3+Fe=3FeCl2设计成原电池,则正极电极反应为
20-21高一下·浙江宁波·阶段练习 查看更多[2]
浙江省余姚市第七中学2020-2021学年高一下学期第一次阶段性考试化学试题(已下线)第11讲 原电池的工作原理(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
更新时间:2021-08-26 23:01:38
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】电化学原理在能量转换、物质制备、防止金属腐蚀等方面应用广泛。
(1)下图是常见电化学装置图
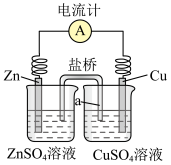
① 负极材料为Zn,其在此装置中的作用是___________ 。
② 若用一根铜丝代替盐桥插入两烧杯中,电流计指针也发生偏转,推测:其中一个为原电池,一个为电解池,写出a端发生的电极反应___________ 。
(2)下图探究金属Fe是否腐蚀的示意图
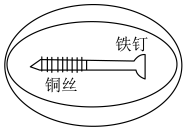
在培养皿中加入一定量的琼脂和饱和NaCl溶液混合,滴入5~6滴酚酞溶液,混合均匀,将缠有铜丝的铁钉放入培养皿中。溶液变红的部位为___________ 端(填“左”或“右”),结合化学用语解释变红的原因___________ 。
(3)下图是氯碱工业电解饱和NaCl溶液的示意图

①电解饱和NaCl溶液的化学方程式是___________ 。
② NaOH溶液从___________ (填b或c)口导出。结合化学用语解释NaOH在此区域生成的原因___________ 。
③电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用___________ 。
(4)我国科学家通过电解,从海水中提取到锂单质,其工作原理如图所示。

①金属锂在电极___________ (填“A”或“B”)生成,发生的是___________ (填“氧化”或“还原”)反应。
②阳极产生两种气体单质,电极反应式分别是___________ ;___________ 。
(1)下图是常见电化学装置图

① 负极材料为Zn,其在此装置中的作用是
② 若用一根铜丝代替盐桥插入两烧杯中,电流计指针也发生偏转,推测:其中一个为原电池,一个为电解池,写出a端发生的电极反应
(2)下图探究金属Fe是否腐蚀的示意图

在培养皿中加入一定量的琼脂和饱和NaCl溶液混合,滴入5~6滴酚酞溶液,混合均匀,将缠有铜丝的铁钉放入培养皿中。溶液变红的部位为
(3)下图是氯碱工业电解饱和NaCl溶液的示意图

①电解饱和NaCl溶液的化学方程式是
② NaOH溶液从
③电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
(4)我国科学家通过电解,从海水中提取到锂单质,其工作原理如图所示。

①金属锂在电极
②阳极产生两种气体单质,电极反应式分别是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】I.实验室以K2MnO4为原料,用两种方法制备高锰酸钾。已知:K2MnO4在浓强碱溶液中可稳定存在,溶液呈墨绿色,当溶液碱性减弱时易发生反应:3 +2H2O=2
+2H2O=2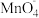 +MnO2↓+4OH-。
+MnO2↓+4OH-。
(1)CO2法。实验装置如图。
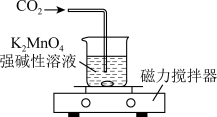
①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知___ 。
②停止通入CO2,过滤除去___ (填化学式,下同),将滤液蒸发浓缩、冷却结晶,抽滤得到KMnO4粗品。若CO2通入过多,产品中可能混有的杂质是___ 。
(2)电解法。实验装置如图。
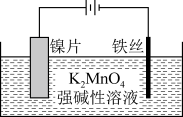
①阳极的电极反应式为___ ,阴极产生的气体为___ (填化学式)。
②与CO2法相比,电解法的主要优点是___ (写一条)。,
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2 2N2+6H2O。则其负极反应式为
2N2+6H2O。则其负极反应式为___ 。
II.(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为___ 。
(5)铁器深埋地下,也会发生严重的电化学腐蚀,原因是一种称为硫酸盐还原菌的细菌,能提供正极反应的催化剂,将土壤中的 还原为S2-,试写出该电化学腐蚀的正极反应式
还原为S2-,试写出该电化学腐蚀的正极反应式___ 。
 +2H2O=2
+2H2O=2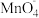 +MnO2↓+4OH-。
+MnO2↓+4OH-。(1)CO2法。实验装置如图。

①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知
②停止通入CO2,过滤除去
(2)电解法。实验装置如图。

①阳极的电极反应式为
②与CO2法相比,电解法的主要优点是
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2
 2N2+6H2O。则其负极反应式为
2N2+6H2O。则其负极反应式为II.(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为
(5)铁器深埋地下,也会发生严重的电化学腐蚀,原因是一种称为硫酸盐还原菌的细菌,能提供正极反应的催化剂,将土壤中的
 还原为S2-,试写出该电化学腐蚀的正极反应式
还原为S2-,试写出该电化学腐蚀的正极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___ 。
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝—空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
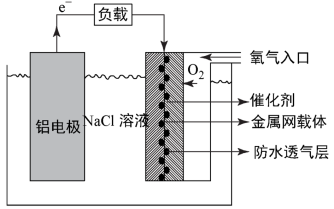
该电池的正极反应方程式为___ ,当铝电极质量减少9克,则另一极通入的氧气的体积在标准状况下为___ 。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。写出反应化学方程式为___ 。
(4)在元素周期表中,砷位于铝的下一周期,与氮元素同主族,写出AsH3分子的电子式为___ ,相同压强下,AsH3的沸点___ NH3(填“大于”或“小于”)。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝—空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。

该电池的正极反应方程式为
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。写出反应化学方程式为
(4)在元素周期表中,砷位于铝的下一周期,与氮元素同主族,写出AsH3分子的电子式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】锌铜原电池装置如图所示.回答下列问题:
(1)该装置能够将化学能转化为___________ 能。
(2)装置中使用的电解质有______________________ 。
(3)盐桥中的 移向
移向___________ 溶液(填“ ”或“
”或“ ”)。
”)。
(4)写出正极的电极反应式______________________ 。
(1)该装置能够将化学能转化为
(2)装置中使用的电解质有
(3)盐桥中的
 移向
移向 ”或“
”或“ ”)。
”)。(4)写出正极的电极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含 废水,电解过程中溶液发生反应:
废水,电解过程中溶液发生反应: ,已知Y是循环的绿色硝化剂N2O5。如图所示:
,已知Y是循环的绿色硝化剂N2O5。如图所示:
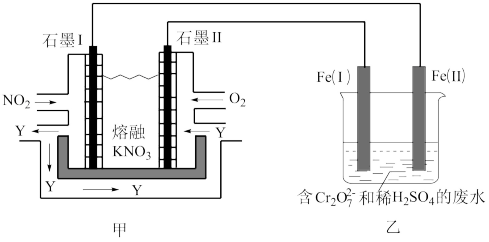
(1)以上装置中的反应共涉及___________ 种还原剂(填阿拉伯数字)。
(2)甲池工作时,电极石墨Ⅰ发生的是___________ 反应(填“氧化”或“还原”);石墨Ⅱ附近发生的电极反应式为___________ 。
(3)工作时,甲池内的 向
向___________ 移动(填“左”或“右”);在相同条件下,消耗的O2和NO2的体积比为___________ 。
(4)乙池中Fe(I)棒上消耗1.00 mol Fe,则甲池消耗标况下的氧气的体积为___________ 。
(5)若外电路中转移了1.0 mol电子,则处理废液中的 的物质的量为
的物质的量为___________ 。
 废水,电解过程中溶液发生反应:
废水,电解过程中溶液发生反应: ,已知Y是循环的绿色硝化剂N2O5。如图所示:
,已知Y是循环的绿色硝化剂N2O5。如图所示:
(1)以上装置中的反应共涉及
(2)甲池工作时,电极石墨Ⅰ发生的是
(3)工作时,甲池内的
 向
向(4)乙池中Fe(I)棒上消耗1.00 mol Fe,则甲池消耗标况下的氧气的体积为
(5)若外电路中转移了1.0 mol电子,则处理废液中的
 的物质的量为
的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】生活中,形式多样化的电池,满足不同的市场需求。图中是几种不同类型的原电池装置。
(1)某实验小组设计了如图甲所示装置:a为铝棒,b为镁棒。
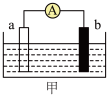
①若容器中盛有NaOH溶液,a极为_______ (填“正极”或“负极):a极的电极反应式是_______ 。
②若容器中盛有浓硫酸,b极的电极反应式是_______ ,导线中电子的流动方向是_______ (填“a→b”或“b→a”)。
(2)铅酸蓄电池常用作汽车电瓶,其构造如图乙所示,按要求回答下列问题:

①负极材料是_______ ,负极的电极反应式是_______
②工作时,电解质溶液中硫酸的浓度_______ (填“增大”“减小”或“不变”)。
③当铅酸蓄电池向外电路提供 时,理论上负极板的质量增加
时,理论上负极板的质量增加_______ g。
(3)如图丙是甲烷空气燃料电池的结构示意图。放电时甲醇应从_______ 处通入(填“a”或“b”),电池内部H+向_______ (填“左”或“右”)移动,正极的电极反应式为_______ ;若a极通入H2,请写出负极的电极反应式_______ 。

(1)某实验小组设计了如图甲所示装置:a为铝棒,b为镁棒。

①若容器中盛有NaOH溶液,a极为
②若容器中盛有浓硫酸,b极的电极反应式是
(2)铅酸蓄电池常用作汽车电瓶,其构造如图乙所示,按要求回答下列问题:

①负极材料是
②工作时,电解质溶液中硫酸的浓度
③当铅酸蓄电池向外电路提供
 时,理论上负极板的质量增加
时,理论上负极板的质量增加(3)如图丙是甲烷空气燃料电池的结构示意图。放电时甲醇应从

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。
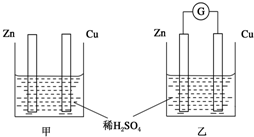
请回答下列问题:
(1)以下叙述中,正确的是__ 。
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
(2)乙装置中,外电路中电子移动方向___ 极流向____ 极(填“Zn”、“Cu”)。
(3)乙装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是________ 。
(4)若开始时乙装置中加入2L,lmol/LH2SO4,当电路中通过0.7mol e-,溶液中Zn2+的浓度是__ mol/L。
(5)乙装置中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:____ 。

请回答下列问题:
(1)以下叙述中,正确的是
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
(2)乙装置中,外电路中电子移动方向
(3)乙装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是
(4)若开始时乙装置中加入2L,lmol/LH2SO4,当电路中通过0.7mol e-,溶液中Zn2+的浓度是
(5)乙装置中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)科学工作者为心脏病人设计的心脏起搏器使用的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧和H+进行工作。回答下列问题:
①正极材料是:___________ ,正极反应为:_______________
②负极材料是:___________ ,负极反应为:_________________
(2)写出下列反应的化学方程式:
①在催化剂条件下苯与液溴发生反应:_________________________________
②乳酸( )与金属钠反应:
)与金属钠反应:___________________________
①正极材料是:
②负极材料是:
(2)写出下列反应的化学方程式:
①在催化剂条件下苯与液溴发生反应:
②乳酸(
 )与金属钠反应:
)与金属钠反应:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】有铜片、锌片和250mL稀硫酸组成的原电池,当在铜片上放出4.48L(标准状况下)的气体时,硫酸恰好完全反应。
(1)该原电池的负极反应式______________________
(2) 原稀硫酸的物质的量浓度是___________ mol/ L
(3)锌片减少的质量__________
(1)该原电池的负极反应式
(2) 原稀硫酸的物质的量浓度是
(3)锌片减少的质量
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】目前,液流电池是电化学储能领域的一个研究热点,优点是储能容量大、使用寿命长。一种简单钒液流电池的电解液存储在储液罐中,放电时的结构及工作原理如图:
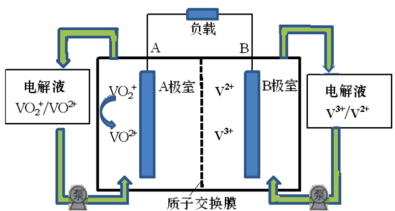
回答下列问题:
(1)放电时,导线中电子方向为_______ ,质子通过质子交换膜方向为______ (填“从A到B”或“从B到A”)。
(2)用该电池作为电源电解饱和食盐水,电解反应的离子方程式为_____________ ;
若欲利用电解所得产物制取含149g NaClO的消毒液用于环境消毒,理论上电解过程中至少需通过电路________ mol电子。
(3)若将该电池电极连接电源充电,则B极连接电源的______ 极,A发生的电极反应为_________ 。

回答下列问题:
(1)放电时,导线中电子方向为
(2)用该电池作为电源电解饱和食盐水,电解反应的离子方程式为
若欲利用电解所得产物制取含149g NaClO的消毒液用于环境消毒,理论上电解过程中至少需通过电路
(3)若将该电池电极连接电源充电,则B极连接电源的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
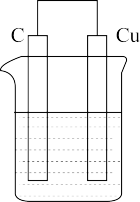
【推荐3】I.依据氧化还原反应2Fe3+(aq)+Cu(s)=Cu2+(aq)+2Fe2+(aq)设计的原电池如图所示。
请回答下列问题:
(1)电解质溶液是_________ (填化学式)溶液。
(2)Cu电极上发生的电极反应为___________ 。
(3)石墨电极上发生反应的类型为_______ (填“氧化”或“还原”)反应。
(4)当有1.6g铜溶解时,通过外电路的电子的物质的量为__________ 。
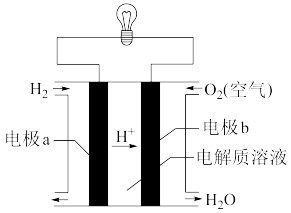
II.某种氢氧燃料电池是用稀硫酸作电解质溶液,其装置如图。则电极a是电池的________ (填“正”或负“)极,电子从该极______ (填“流入”或“流出”),该电池正极的电极反应式为___________ 。

请回答下列问题:
(1)电解质溶液是
(2)Cu电极上发生的电极反应为
(3)石墨电极上发生反应的类型为
(4)当有1.6g铜溶解时,通过外电路的电子的物质的量为
II.某种氢氧燃料电池是用稀硫酸作电解质溶液,其装置如图。则电极a是电池的

您最近一年使用:0次




