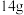某电动汽车的锂离子电池的工作原理如图所示。下列叙述正确的是
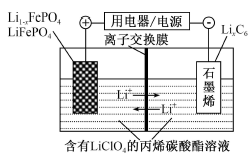

| A.放电时,Li+从正极脱嵌,经过电解质溶液和离子交换膜嵌入负极 |
| B.放电时,正极反应式为LixC6-xe-=C6+xLi+ |
C.充电时,阳极发生还原反应: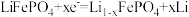 |
D.电池工作时,负极材料减少a g,转移电子 |
更新时间:2021-11-04 08:11:33
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】如图所示装置,电流表指针发生偏转,同时 A 极逐渐变粗,B 极逐渐变细,C 为电解质溶液,则 A、B、C 应是下列各组中的
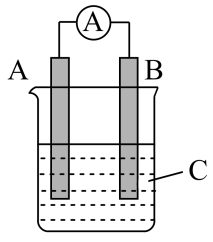

| A.A是Zn,B是Cu,C 是硫酸铜溶液 |
| B.A是Cu,B是Zn,C 为硫酸铜溶液 |
| C.A是Fe,B是Ag,C 为稀硝酸溶液 |
| D.A是Ag,B是Fe,C为稀硝酸溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O=2Ag+Zn(OH)2。下列说法中不正确的是
| A.原电池放电时,负极上发生反应的物质是Zn |
| B.工作时,负极区溶液c(OH-)减小 |
| C.正极发生的反应是Ag2O+2e-+H2O=2Ag+2OH- |
| D.外电路中电流由Zn流向Ag2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】原电池为电化学建构认识模型奠定了重要的基础,下图装置中的盐桥装有琼脂凝胶、内含氯化钾。下列对于该原电池说法错误的是
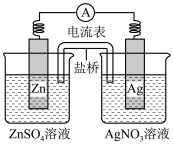

| A.该装置能将化学能转化为电能 |
B.电池工作时,导线中电子流向为Zn Cu Cu |
| C.负极反应为Zn-2e-=Zn2+,发生还原反应 |
| D.电池工作时,盐桥中的K+移向AgNO3溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列有关化学电源的说法,正确的是
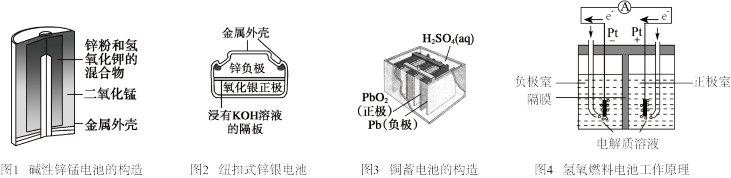

A.图1碱性锌锰电池中, 电极发生还原反应, 电极发生还原反应, 电极发生氧化反应 电极发生氧化反应 |
B.图2纽扣式锌银电池中,正极的电极反应式为: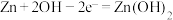 |
| C.图3铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
D.图4氢氧燃料电池中,负极室的 通过隔膜进入正极室 通过隔膜进入正极室 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】我国科学家研制出“可充室温Na-CO2电池”(Rechargeable Room-Temperature Na-CO2 Batter-ies)现已取得突破性进展,其有望取代即将“枯竭”的锂电池,该电池结构如图所示。下列说法错误的是
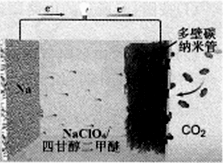

| A.电池工作时,正极发生反应:4Na++3CO2+4e-==2Na2CO3+C |
| B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.46 g |
| C.多壁碳纳米管的作用主要是导电及吸附CO2 |
| D.电池中四甘醇二甲醚可用饱和食盐水代替实现Na+传导 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】利用微生物燃料电池(MFC)处理废水,可实现碳氮联合转化。某微生物燃料电池的工作原理如图所示。下列说法不正确的是
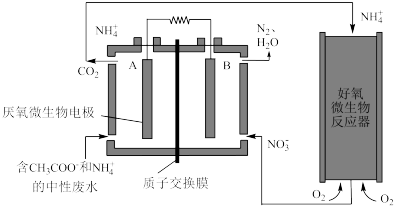

A.电子移动方向是从A电极流向B电极,溶液中 的移动方向从左到右 的移动方向从左到右 |
B.B电极反应式为: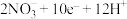  |
C.相同条件下,A极区生成的 与B极区生成的 与B极区生成的 的体积之比为5∶4 的体积之比为5∶4 |
| D.该电池在高温情况下无法正常工作 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和食盐水,如图所示,有关说法正确的是

| A.燃料电池工作时,通入甲烷电极的电极反应式为CH4+2H2O—8e—=CO2+8H+ |
| B.闭合开关K后,b电极上有Cl2生成 |
| C.若每个电池甲烷通入量为1L(标准状况),且反应完全,理论上最多能产生氯气的体积为4L(标准状况) |
D.电解饱和食盐水总反应的离子方程式为Cl—+H2O OH—+H2↑+Cl2↑ OH—+H2↑+Cl2↑ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
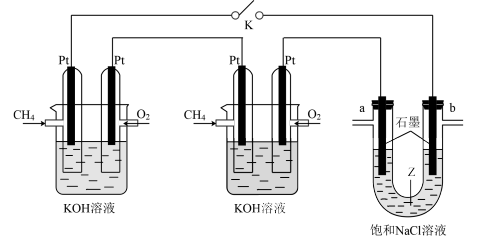
【推荐1】设计如图所示的原电池装置,既能使NH3和NO2转化为对环境无污染的物质,又能充分利用化学能。下列有关说法不正确的是
| A.电极A为负极,发生氧化反应 |
| B.当有4.48L NO2(标准状况)被处理时,转移电子物质的量为0.4mol |
| C.电流从电极B经导线流向电极A,再经电解质溶液回到电极B |
| D.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】一种聚合物锂电池通过充、放电可实现“大气固碳”(如图所示)。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化释放出CO2和O2。下列说法正确的是
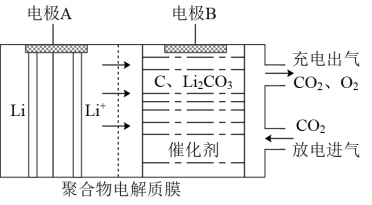
| A.该电池可选用含Li+的水溶液作电解质 |
| B.图中Li+的移动方向是充电时的移动方向 |
| C.充电时,阳极发生的反应为2Li2CO3+C-4e-=3CO2+4Li+ |
| D.该电池每循环充、放电子各4mol,理论上可固定CO2标准状况下22.4L |
您最近一年使用:0次

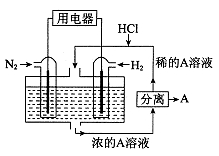
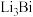 。下列说法正确的是
。下列说法正确的是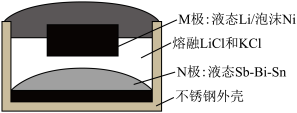
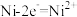

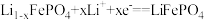 ;下列说法不正确的是
;下列说法不正确的是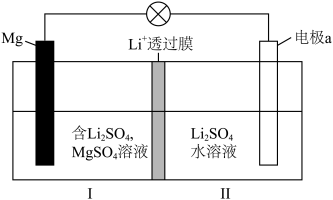
 极为阴极
极为阴极 从I室向II室迁移
从I室向II室迁移 溶液的浓度增大
溶液的浓度增大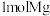 ,电极a质量理论上增加
,电极a质量理论上增加