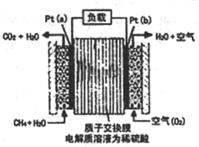
甲醇燃料电池在碱性条件下的电池反应为2CH3OH+3O2+4OH-=2CO +6H2O。则下列有关说法不正确的是
+6H2O。则下列有关说法不正确的是
 +6H2O。则下列有关说法不正确的是
+6H2O。则下列有关说法不正确的是| A.O2在正极参与反应 |
| B.该电池使用一段时间后溶液pH变小 |
C.负极反应为:CH3OH-6e-+8OH-=CO +6H2O +6H2O |
| D.每转移0.6 mol电子,则消耗氧气的体积为3.36L |
21-22高二上·福建福州·期中 查看更多[7]
福建省福州市八县(市)协作校2021-2022学年高二上学期期中联考化学试题(已下线)期末综合测试卷02-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)第25讲 化学电源(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)江西省南昌市知行中学2021-2022学年高二上学期12月月考化学试题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高二上学期开学考试化学试题江西省宜春市丰城市2022-2023学年高二上学期1月期末化学试题内蒙古自治区第二地质中学2023-2024学年高二上学期12月期中考试化学试题
更新时间:2021-11-13 13:46:08
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列实验装置(夹持装置已略去)选择正确且能达到相应实验目的的是
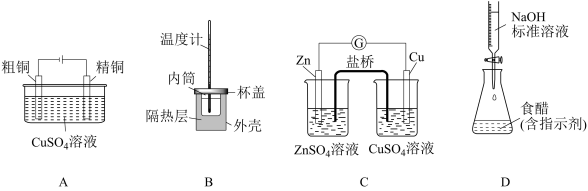

| A.图A是电解精炼铜 | B.图B是测定中和反应反应热 |
| C.图C是实现化学能转化为电能 | D.图D是测定食醋浓度 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】如图是某同学设计的原电池装置,下列叙述中正确的是
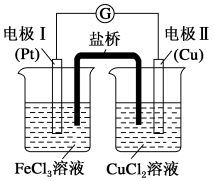

| A.电极I上发生还原反应,作原电池的负极 |
| B.电极II的电极反应式为:Cu2++2e﹣=Cu |
| C.该原电池的正极电极反应式为:Fe3++e﹣=Fe2+ |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】利用如图装置进行实验,甲乙两池均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,灵敏电流计指针发生偏转(提示:Ag+ 浓度越大,氧化性越强),下列说法不正确的是
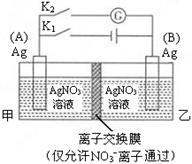

| A.闭合K1,断开K2后,A电极增重 |
| B.闭合K1,断开K2后,乙池溶液中Ag+浓度增大 |
| C.断开K1,闭合K2后,B电极发生氧化反应 |
D.断开K1,闭合K2后, 向A电极移动 向A电极移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】2022北京冬奥会赛区内使用氢燃料清洁能源车辆,这种车辆利用原电池原理提供清洁电能,某氢氧燃料电池工作原理如图所示。下列说法正确的是

| A.电极a为电池的正极 |
B.电池工作过程中, 向负极迁移 向负极迁移 |
C.电极b表面反应为 |
D.氢氧燃料电池中正极消耗 (标准状况)气体时,电路中通过的电子数目为2NA (标准状况)气体时,电路中通过的电子数目为2NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】2021年1月20日中国科学院和中国工程院评选出2020年世界十大科技进展,排在第四位的是一种可借助光将二氧化碳转化为甲烷的新型催化转化方法:CO2+4H2=CH4+2H2O,这是迄今最接近人造光合作用的方法。某光电催化反应器如图所示,A电极是Pt/CNT,B电极是TiO2。通过光解水,可由CO2制得异丙醇[CH3CH(OH)CH3]。下列说法不正确的是
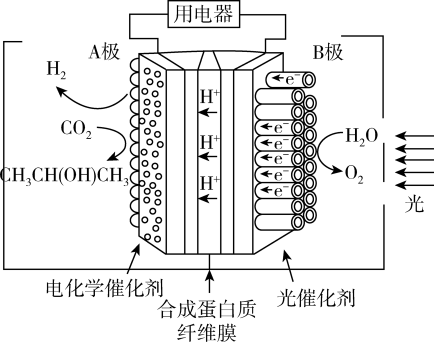

| A.A极是电池的正极 |
| B.B极的电极反应为2H2O-4e-=O2↑+4H+ |
| C.A极选用高活性和高选择性的电化学催化剂能有效抑制析氢反应 |
| D.每生成30g异丙醇转移的电子数目为9mol |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。下列有关叙述正确的是
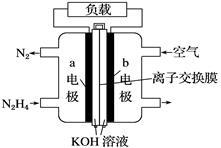

| A.该燃料电池放电时,正极发生氧化反应,pH变大 |
| B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O |
| C.放电时,电流从a极经过负载流向b极 |
| D.其中的离子交换膜需选用阳离子交换膜 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。

下列说法正确的是

下列说法正确的是
| A.放电时,Mo箔为电池的阳极 |
| B.充电时,正极反应为Fe[Fe(CN)6]+2e-+2Na+=Na2Fe[Fe(CN)6] |
| C.充电时,Na+通过交换膜从左室移向右室 |
| D.外电路中通过0.2mol电子时,正极质量变化为2.4g |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,此装置称为甲烷燃料电池。下列叙述中正确的是( )
①通入CH4的电极为正极;
②正极的电极反应式为:O2+2H2O+4e-=4OH-;
③通入CH4的电极反应式为:CH4+2O2+4e-=CO2+2H2O;
④负极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动。
①通入CH4的电极为正极;
②正极的电极反应式为:O2+2H2O+4e-=4OH-;
③通入CH4的电极反应式为:CH4+2O2+4e-=CO2+2H2O;
④负极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动。
| A.①③⑤ | B.②④⑥ | C.④⑤⑥ | D.①②③ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
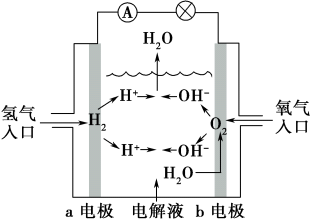
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-====2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列有关氢氧燃料电池的说法错误的是
| A.H2通入正极区 |
| B.正极发生还原反应 |
| C.氢氧燃料电池的总反应为2H2+O2=2H2O |
| D.氢氧燃料电池具有清洁、安全、高效等特点 |
您最近一年使用:0次


 向a极迁移
向a极迁移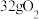 ,理论上转移2mol电子
,理论上转移2mol电子