利用物质由高浓度向低浓度自发扩散的能量可制成浓差电池。在海水中的不锈钢制品,缝隙处氧浓度比海水低,易形成浓差电池而发生缝隙腐蚀。缝隙处腐蚀机理如图所示。下列说法不正确的是
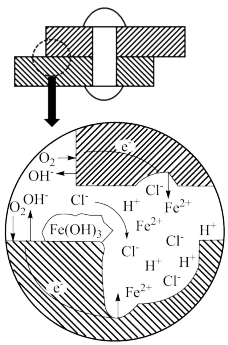
| A.金属缝隙内表面为负极,外自由表面为正极 |
| B.缝隙内溶液pH增大,加快了缝隙内腐蚀速率 |
| C.为了维持电中性,海水中大量Cl-进入缝隙 |
| D.正极的电极反应为O2+2H2O+4e-=4OH- |
21-22高三上·福建福州·阶段练习 查看更多[7]
福建省福州第三中学2021-2022学年高三上学期第五次质量检测化学试题(已下线)第15练 反应原理综合-2022年【寒假分层作业】高二化学(人教版2019选择性必修2)(已下线)押新高考卷12题 电化学基础-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)浙江省杭州市浙江大学附属中学2021-2022学年高二上学期期末考试化学试题(已下线)考点20 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)宁夏回族自治区银川一中2024届高三下学期考前热身训练化学试卷2
更新时间:2021-12-31 23:04:19
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】某新型电池的工作原理如图所示,放电时总反应为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2,下列说法错误的是
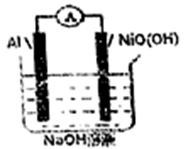

| A.放电时,正极的电极反应式为NiO(OH)+e-+H2O=Ni(OH)2+OH- |
| B.充电时,阳极的电极反应式为AlO2--3e-+2H2O=A1+4OH- |
| C.放电时,Na+向正极移动 |
| D.充电时,当电路中通过3NA 电子时,阳极质量减少3g |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】最早使用的化学电池是锌锰电池,即大家熟悉的干电池,其结构如图所示。
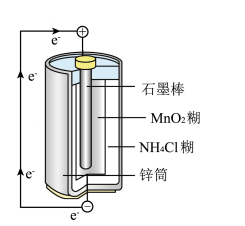
尽管这种电池的历史悠久,但对于它的化学过程人们尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2e-+2NH4+===Mn2O3+H2O+2NH3↑
F极:Zn-2e-===Zn2+
总反应式:2MnO2+Zn+2NH4+===Mn2O3+Zn2++2NH3↑+H2O
下列说法正确的是

尽管这种电池的历史悠久,但对于它的化学过程人们尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2e-+2NH4+===Mn2O3+H2O+2NH3↑
F极:Zn-2e-===Zn2+
总反应式:2MnO2+Zn+2NH4+===Mn2O3+Zn2++2NH3↑+H2O
下列说法正确的是
| A.E极是电池的正极,发生的是氧化反应 |
| B.F极是电池的负极,发生的是氧化反应 |
| C.从结构上分析,锌锰电池应属于可充电电池 |
| D.锌锰电池内部发生的氧化还原反应是可逆的 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】对于铁、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是
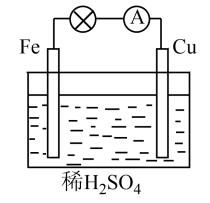
①Fe是负极 ②电子由Fe经外电路流向Cu,后再通过溶液流回到Fe
③Fe — 2e— = Fe2+ ④ H+在溶液中由Cu棒向Fe棒迁移
⑤一段时间后溶液的H+浓度变小 ⑥一段时间后溶液由无色变为浅绿色

①Fe是负极 ②电子由Fe经外电路流向Cu,后再通过溶液流回到Fe
③Fe — 2e— = Fe2+ ④ H+在溶液中由Cu棒向Fe棒迁移
⑤一段时间后溶液的H+浓度变小 ⑥一段时间后溶液由无色变为浅绿色
| A.①② | B.②③④ | C.①③⑤⑥ | D.①②③④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列装置中,可以实现反应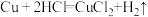 的是
的是
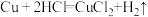 的是
的是A.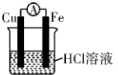 | B.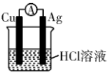 |
C.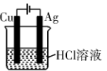 | D.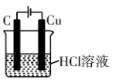 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。

下列说法不正确的是

下列说法不正确的是
| A.上述正极反应均为O2+4e-+2H2O=4OH- |
| B.在不同溶液中,Cl-是影响吸氧腐蚀速率的主要因素 |
| C.向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快 |
| D.在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】某种钢闸门保护法原理示意图如下,下列说法不正确 的是
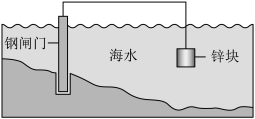

| A.锌块发生氧化反应:Zn-2e–= Zn2+ |
| B.钢闸门有电子流入,可以有效减缓腐蚀 |
| C.若通过外加电源保护钢闸门,应将钢闸门与电源正极相连 |
| D.锅炉内壁装上若干镁合金的防腐原理与该种钢闸门保护法原理相同 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】化学与生产、生活密切相关。下列说法不正确的是
| A.氨气与氯化氢反应生成氯化铵的过程属于氮的固定 |
| B.煤的气化、煤的液化和煤的干馏均属于化学变化 |
| C.淀粉在稀硫酸催化作用下转化为葡萄糖的过程属于多糖水解 |
| D.将钢铁闸门与电源负极相连的防腐措施属于外加电流保护法 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列物质的应用中,与氧化还原反应无关的是
| A.利用CO从铁矿石中获得铁 | B.在船体上镶嵌锌块避免船体遭受腐蚀 |
| C.节日燃放的烟花呈现金属元素的焰色 | D.工业上以氨气为原料生产硝酸 |
您最近一年使用:0次

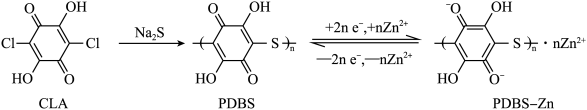
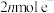 ,理论消耗
,理论消耗
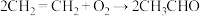 。下列有关说法错误的是
。下列有关说法错误的是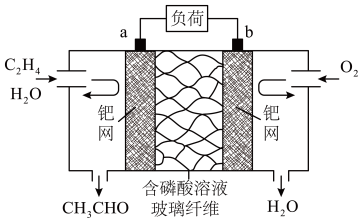
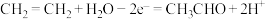
 参加反应,则迁移
参加反应,则迁移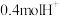
 NH
NH +OH-
+OH- +H2O
+H2O +OH-
+OH- 水解生成
水解生成 胶体
胶体 水解使溶液显碱性
水解使溶液显碱性

