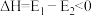已知:H2(g)+F2(g)=2HF(g) ΔH=-270 kJ·mol-1。下列说法错误的是

| A.1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ |
| B.在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量 |
| C.该反应的逆反应是吸热反应 |
| D.该反应过程的能量变化可用如图来表示 |
更新时间:2022-01-13 17:21:29
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】下列反应属于吸热反应的是
A. |
B. |
| C.反应物的总能量大于生成物的总能量 |
| D.断裂反应物全部化学键所需能量大于形成生成物全部化学键所需能量 |
您最近一年使用:0次
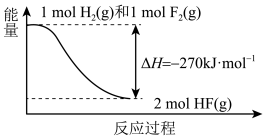
【推荐2】氢气和氧气反应生成水的能量关系如图所示,下列说法不正确的是

| A.∆H2<0;∆H5>0 | B.∆H1>∆H2+∆H3+∆H4 |
| C.∆H1+∆H2+∆H3+∆H4+∆H5=0 | D.O-H键键能为 |∆H1| |∆H1| |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】下列关于化学反应与能量的说法错误的是
| A.化学反应中的能量变化均表现为热量的变化 |
| B.化学键的断裂和形成与反应放热和吸热有关 |
| C.Ba(OH)2·8H2O与NH4Cl的反应属于吸热反应 |
| D.判断反应是吸热还是放热可以根据反应物和生成物的总能量的大小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
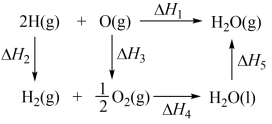
【推荐2】N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g)=CO2(g)+N2(g)ΔH,有关化学反应的物质变化过程如图1所示,能量变化过程如图2所示,下列说法正确的是


| A.由图1、2可知ΔH=ΔH1+ΔH2=ΔE1-ΔE2 |
| B.加入P2O+作为反应物,可使反应的焓变减小 |
| C.由图2可知ΔE1大于ΔE2 |
| D.物质的量相等的N2O、CO的键能总和大于CO2、N2的键能总和 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】反应H2+Cl2=2HCl(△H<0)的机理包含:①Cl2→2Cl(慢)②H2+Cl→HCl+H(快)③Cl2+H→HCl+Cl(快)等.下列说法正确的是( )
| A.断开1molH﹣H键需要的能量小于断开1molCl﹣Cl键需要的能量 |
| B.反应在光照和加热条件下的△H不同 |
| C.反应①的活化能小于反应②的活化能 |
| D.已知反应②的△H>0,则反应③的△H一定小于0 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】乙烯与水发生加成反应制备乙醇的能量变化过程如所示,下列说法错误的是
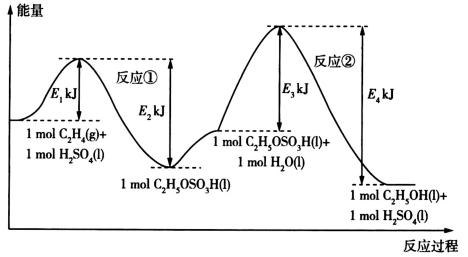

| A.乙烯与水发生加成反应制备乙醇的总反应的ΔH<0 |
| B.制备过程的速率主要由反应②决定 |
| C.由图可知1molC2H4(g)的总能量高于1molC2H5OH(l)的总能量 |
| D.C2H5OSO3H(l)+H2O(l)=C2H5OH(l)+H2SO4(l) ΔH=(E4-E3)kJ•mol-1 |
您最近一年使用:0次

 溶液中加入适量
溶液中加入适量 溶液,在5min时测得生成
溶液,在5min时测得生成 的体积为
的体积为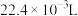 (标准状况下)。此反应分两步进行:
(标准状况下)。此反应分两步进行: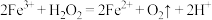 ,
, ,
,
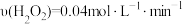
 的作用是增大过氧化氢的分解速率
的作用是增大过氧化氢的分解速率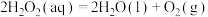 的
的