反应热产生的原因:以H2(g)+Cl2(g)=2HCl(g)为例说明_______ 。
更新时间:2022-02-10 13:26:56
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,CO2和NF3均为温室气体,NF3存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年,如表所示是几种化学键的键能。
(1)①过程N2(g)→2N(g)___________ (填“吸收”或“放出”)能量。
②反应N2(g)+3F2(g)=2NF3(g) ΔH=___________ 。
(2)已知:①C(s)+O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1
现有2 mol炭粉和氢气组成的悬浮气,在足量氧气中完全燃烧只生成CO2(g)和H2O(l),共放出679.3 kJ的热量,则混合物中C与H2的物质的量之比为___________ 。
(3)通氧气自热法生产CaC2包含下列反应:
CaO(s)+3C(s)=CaC2(s)+CO(g) ΔH= +464.1 kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH= -110.5 kJ·mol-1
O2(g)=CO(g) ΔH= -110.5 kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO。则为了维持热平衡,每生产1 mol CaC2,投料的量为1 mol CaO、___________ mol C 及___________ mol O2。
| 化学键 | N≡N | F—F | N—F |
| 键能/(kJ·mol-1) | 946 | 154.8 | 283.0 |
(1)①过程N2(g)→2N(g)
②反应N2(g)+3F2(g)=2NF3(g) ΔH=
(2)已知:①C(s)+O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1
现有2 mol炭粉和氢气组成的悬浮气,在足量氧气中完全燃烧只生成CO2(g)和H2O(l),共放出679.3 kJ的热量,则混合物中C与H2的物质的量之比为
(3)通氧气自热法生产CaC2包含下列反应:
CaO(s)+3C(s)=CaC2(s)+CO(g) ΔH= +464.1 kJ·mol-1
C(s)+
 O2(g)=CO(g) ΔH= -110.5 kJ·mol-1
O2(g)=CO(g) ΔH= -110.5 kJ·mol-1若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO。则为了维持热平衡,每生产1 mol CaC2,投料的量为1 mol CaO、
您最近一年使用:0次
【推荐2】回答下列问题:
(1)金刚砂的主要成分的化学式是___________ 。
(2) 分子的空间结构为
分子的空间结构为___________ ,共价键为___________ 键(填“极性”或“非极性”)。
(3)比较还原性强弱:
___________  (填“>”“<”或“=”);用一个离子方程式说明与
(填“>”“<”或“=”);用一个离子方程式说明与 与
与 的还原性相对强弱
的还原性相对强弱___________ 。
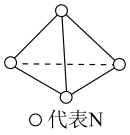
(4)科学家已获得了气态 分子,其结构为正四面体。已知断裂1molN-N吸收193kJ能量,断裂1molN≡N吸收946kJ能量,则
分子,其结构为正四面体。已知断裂1molN-N吸收193kJ能量,断裂1molN≡N吸收946kJ能量,则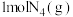 完全转化为
完全转化为 时
时___________ (填“吸收”或“放出”)能量。
(1)金刚砂的主要成分的化学式是
(2)
 分子的空间结构为
分子的空间结构为(3)比较还原性强弱:

 (填“>”“<”或“=”);用一个离子方程式说明与
(填“>”“<”或“=”);用一个离子方程式说明与 与
与 的还原性相对强弱
的还原性相对强弱(4)科学家已获得了气态
 分子,其结构为正四面体。已知断裂1molN-N吸收193kJ能量,断裂1molN≡N吸收946kJ能量,则
分子,其结构为正四面体。已知断裂1molN-N吸收193kJ能量,断裂1molN≡N吸收946kJ能量,则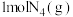 完全转化为
完全转化为 时
时
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】根据要求回答下列问题:
(1)工业上利用镍与CO形成化合物Ni(CO)4分离提纯镍。C原子能量最高的电子为_______ 轨道上的电子,该轨道呈_______ 形。CO的结构式为_______ ,WgCO中含 键数目为
键数目为_______ 。
(2)硅是重要的半导体材料,构成了现代电子工业的基础。基态Si原子中,电子占据的最高能层的符号为_______ ,核外电子的运动状态有_______ 种,有_______ 种能量不同的电子。
(3)有关碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_______ 。
(4)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种):正四面体形分子_______ ,三角锥形分子_______ ,V形分子_______ 。
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从原子核外电子结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。
(1)工业上利用镍与CO形成化合物Ni(CO)4分离提纯镍。C原子能量最高的电子为
 键数目为
键数目为(2)硅是重要的半导体材料,构成了现代电子工业的基础。基态Si原子中,电子占据的最高能层的符号为
(3)有关碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
(4)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种):正四面体形分子
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从原子核外电子结构角度来看,Fe2+易被氧化成Fe3+的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】已知25℃、101 kPa时某些物质的燃烧热数据如下:
(1)相同质量的上述八种物质,完全燃烧放热最多的名称是____ 。
(2)石墨与金刚石互为____ 。
a.同位素 b.同素异形体 c.同分异构体 d.同系物
常温常压下,二者更稳定的是___ 。(填中文名称)
(3)在标准状况下,22.4LCO和C2H2的混合气体在过量的氧气中完全燃烧放出1096.6 kJ的热,则燃烧产生的CO2的物质的量为___ mol。
(4)估算在Ni作催化剂时,乙烯与氢气发生加成反应的焓变。C2H4(g)+H2(g)=C2H6(g) ΔH=____ 。
(5)已知破坏下列化学键需要吸收的能量如下:
根据(4)的结论,估算C-H键的键能为____ kJ/mol。
a.322.5 b.422.5 c.522.5 d.622.5
| 名称 | 化学式 | ΔH (kJ/mol) | 名称 | 化学式 | ΔH (kJ/mol) |
| 石墨 | C(s) | −393.5 | 乙烷 | C2H6(g) | −1560 |
| 金刚石 | C(s) | −395.0 | 乙烯 | C2H4(g) | −1411 |
| 氢气 | H2(g) | −285.8 | 乙炔 | C2H2(g) | −1300 |
| 一氧化碳 | CO(g) | −283.0 | 乙醇 | C2H5OH(l) | −1367 |
(1)相同质量的上述八种物质,完全燃烧放热最多的名称是
(2)石墨与金刚石互为
a.同位素 b.同素异形体 c.同分异构体 d.同系物
常温常压下,二者更稳定的是
(3)在标准状况下,22.4LCO和C2H2的混合气体在过量的氧气中完全燃烧放出1096.6 kJ的热,则燃烧产生的CO2的物质的量为
(4)估算在Ni作催化剂时,乙烯与氢气发生加成反应的焓变。C2H4(g)+H2(g)=C2H6(g) ΔH=
(5)已知破坏下列化学键需要吸收的能量如下:
| C-C | C=C | H-H |
| 347kJ/mol | 619kJ/mol | 436kJ/mol |
根据(4)的结论,估算C-H键的键能为
a.322.5 b.422.5 c.522.5 d.622.5
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】我国航天航空事业蒸蒸日上,航天航空的关键技术是火箭,火箭燃料有液氢、乙炔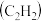 、甲烷、煤油、肼
、甲烷、煤油、肼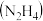 等。请回答下列问题:
等。请回答下列问题:
(1)已知肼的结构简式可表示为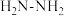 。
。
①肼分子中的化学键类型为_______________________ 。
②肼在氧气中燃烧生成无毒的物质,则反应中肼断裂的化学键有N—H键、_______________________ ,新形成的化学键有_______________________ 。
③根据肼燃烧过程中的能量变化,说明反应物能量之和_______________________ (填“大于”“等于”或“小于”)生成物能量之和。
(2)氢燃料汽车中氢的燃烧与火箭中氢的燃烧最大的不同在于前者使用的是空气作氧化剂,而后者使用的是液氧。火箭中不能使用液化空气,原因是_______________________ 。
(3)火箭发射前,当液氢、液氧加到一定量后,技术人员还要不停地补加,请你说出这种做法的原因_______________________ 。
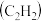 、甲烷、煤油、肼
、甲烷、煤油、肼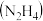 等。请回答下列问题:
等。请回答下列问题:(1)已知肼的结构简式可表示为
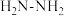 。
。①肼分子中的化学键类型为
②肼在氧气中燃烧生成无毒的物质,则反应中肼断裂的化学键有N—H键、
③根据肼燃烧过程中的能量变化,说明反应物能量之和
(2)氢燃料汽车中氢的燃烧与火箭中氢的燃烧最大的不同在于前者使用的是空气作氧化剂,而后者使用的是液氧。火箭中不能使用液化空气,原因是
(3)火箭发射前,当液氢、液氧加到一定量后,技术人员还要不停地补加,请你说出这种做法的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】 已知:
已知:
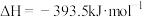 ;
;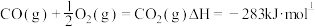 ,根据上述信息,写出C转化为CO的热化学方程式
,根据上述信息,写出C转化为CO的热化学方程式_________________________________________ 。
 已知热化学方程式:
已知热化学方程式: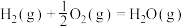
 ,该反应的活化能为
,该反应的活化能为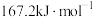 ,则其逆反应的活化能为
,则其逆反应的活化能为___________ 
 用
用 催化还原
催化还原 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:

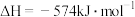


若用标准状况下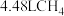 还原
还原 生成
生成 ,反应中转移的电子总数为
,反应中转移的电子总数为_______  用阿伏加 德罗常数
用阿伏加 德罗常数 表示
表示 ,放出的热量为
,放出的热量为_______ kJ。
 已知
已知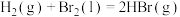 ;
;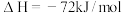 。蒸发1mol
。蒸发1mol 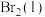 需要吸收的能量为30kJ,其它相关数据如下表,则表中 a为
需要吸收的能量为30kJ,其它相关数据如下表,则表中 a为__________________
 已知:
已知:
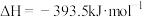 ;
;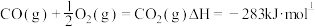 ,根据上述信息,写出C转化为CO的热化学方程式
,根据上述信息,写出C转化为CO的热化学方程式 已知热化学方程式:
已知热化学方程式: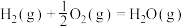
 ,该反应的活化能为
,该反应的活化能为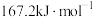 ,则其逆反应的活化能为
,则其逆反应的活化能为
 用
用 催化还原
催化还原 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:
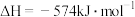


若用标准状况下
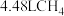 还原
还原 生成
生成 ,反应中转移的电子总数为
,反应中转移的电子总数为 用阿伏加 德罗常数
用阿伏加 德罗常数 表示
表示 ,放出的热量为
,放出的热量为 已知
已知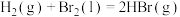 ;
;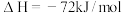 。蒸发1mol
。蒸发1mol 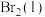 需要吸收的能量为30kJ,其它相关数据如下表,则表中 a为
需要吸收的能量为30kJ,其它相关数据如下表,则表中 a为 | 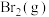 | 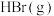 | |
| 1mol分子中的化学键断裂时 需要吸收的能量  | 436 | a | 369 |
您最近一年使用:0次



