某研究学习小组在实验室中模拟石油的炼制,设计了如图的装置。
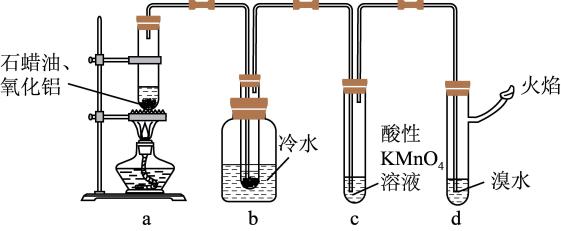
实验过程中,可观察到b中试管内有少量液体凝结且闻到有汽油的气味,c中试管内酸性高锰酸钾溶液褪色。
(1)实验研究小组模拟的是___________ (填化工工艺名称)。
(2)b中试管内的液体___________ (填“能”或“不能”)用来萃取溴水中的溴。若不能,请说明理由:___________ (若能,此空不填)。
(3)c中试管内酸性KMnO4溶液褪色,体现了酸性KMnO4溶液的___________ 性。
(4)写出十六烷裂化得到辛烷和辛烯的化学方程式:___________ 。
(5)实验过程中,装置d中的溴的四氯化碳溶液褪色,写出验证烯烃与溴水的反应是加成反应而不是取代反应的方法:___________ 。

实验过程中,可观察到b中试管内有少量液体凝结且闻到有汽油的气味,c中试管内酸性高锰酸钾溶液褪色。
(1)实验研究小组模拟的是
(2)b中试管内的液体
(3)c中试管内酸性KMnO4溶液褪色,体现了酸性KMnO4溶液的
(4)写出十六烷裂化得到辛烷和辛烯的化学方程式:
(5)实验过程中,装置d中的溴的四氯化碳溶液褪色,写出验证烯烃与溴水的反应是加成反应而不是取代反应的方法:
更新时间:2022-03-02 19:22:03
|
相似题推荐
【推荐1】过二硫酸钾( )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
实验(一):探究过二硫酸钾的强氧化性。
探究 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:
(1)同学甲用碰撞理论分析,实验Ⅰ中 和
和 反应很慢的主要原因是
反应很慢的主要原因是___________
(2)同学乙猜想实验Ⅱ中 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:
(ⅰ)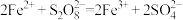 ;(ⅱ)___________。
;(ⅱ)___________。
①补充反应(ⅱ):___________ 。
②请你设计实验证明同学乙的猜想:___________ 。
(3)查阅文献知,氧化性: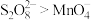 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是___________ ,该反应的离子方程式为___________ 。
实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
取适量的 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
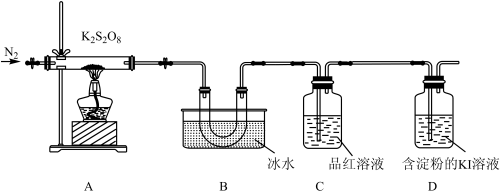
(4)加热之前,先通入一段时间 ,当观察到D中
,当观察到D中___________ (填实验现象)时点燃酒精灯。
(5)B中U形管收集的物质是___________ (填化学式)。
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为___________ 。
 )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。实验(一):探究过二硫酸钾的强氧化性。
探究
 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:| 实验 | 操作 | 现象 |
| Ⅰ | 在10L含淀粉的 的 的 溶液中滴加 溶液中滴加   溶液 溶液 | 一段时间后,溶液缓慢变蓝 |
| Ⅱ | 在 含淀粉的 含淀粉的 的 的 溶液中先滴几滴 溶液中先滴几滴 的 的 溶液,再滴加 溶液,再滴加   溶液 溶液 | 溶液迅速变蓝 |
 和
和 反应很慢的主要原因是
反应很慢的主要原因是(2)同学乙猜想实验Ⅱ中
 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:(ⅰ)
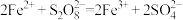 ;(ⅱ)___________。
;(ⅱ)___________。①补充反应(ⅱ):
②请你设计实验证明同学乙的猜想:
(3)查阅文献知,氧化性:
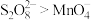 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
| 气体 |  |  |  |
| 熔点/℃ | 16.8 | -72.7 | -218.4 |
| 沸点/℃ | 44.8 | -10 | -182.9 |
 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
(4)加热之前,先通入一段时间
 ,当观察到D中
,当观察到D中(5)B中U形管收集的物质是
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中
 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,主要原因是发酵过程产生的菌种多达百种,难以控制而产生对神经有毒的甲醇等物质。科学酿酒需加SO2等辅料,我国国家标准(GB27602014)规定葡萄酒中SO2的残留量≤0.25 g·L-1。
(1)葡萄酒中添加SO2的作用可能是_______。
Ⅰ.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3.设计如图1的实验:
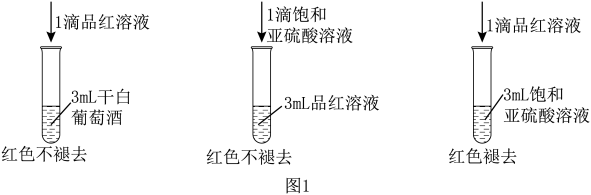
(2)SO2水溶液显酸性,用离子方程式说明_______ 。
(3)甲同学得出的实验结论是干白葡萄酒中不含SO2或H2SO3.这个结论_______ (填“成立”或“不成立”),理由是_______ 。
Ⅱ.实验方案二
用如图实验装置探究二氧化硫的氧化性。按图2充入气体,连接装置,关闭旋塞1和2。
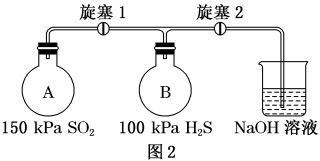
(4)打开旋塞1,可观察到的主要现象是_______ 。
(5)若A瓶和B瓶的体积相等,恢复到常温,关闭旋塞1,打开旋塞2,可观察到的现象是_______ ,此时B瓶中可能发生反应的化学方程式为_______ 。
(6)若图2装置中充入H2S和SO2的混合气体共1mol,充分反应后,所得氧化产物比还原产物多0.25mol,则原混合气体中H2S和SO2的体积比可能是_______。
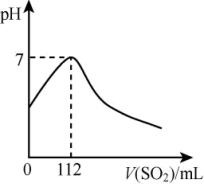
(7)在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为_______ mol/L。
在上述实验中,采用铜和浓硫酸制备SO2,应放置在下列_______ (填序号)中进行反应。

探究二氧化硫的还原性
(8)图2装置中将氢氧化钠溶液换为_______ 溶液,即可验证二氧化硫还原性。
(9)将SO2气体通入下列装置中,一定不可能产生沉淀的共_______ 项。(填写数字)

(10)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物HCl和H2SO4。请写出该反应的化学方程式_______ 。
Ⅲ.实验方案三
搭建图示装置为测定某葡萄酒中SO2的含量:
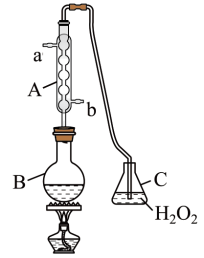
实验步骤如下:在B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应。除去C中剩余的H2O2后,用0.090 0 mol·L-1 NaOH溶液测定反应生成的酸,消耗NaOH溶液25.00 mL。
(11)C中通入SO2发生反应的化学方程式为_______ 。
(12)通过计算求出该葡萄酒中SO2的含量(以g·L-1为单位,即每升葡萄酒中含有SO2的质量)_______ 。
(13)该测定结果比实际值偏高,可能的原因是_______ 。
(14)针对此原因提出一条改进措施:_______ 。
(1)葡萄酒中添加SO2的作用可能是_______。
| A.氧化细菌 | B.抗氧化 | C.漂白 | D.增酸作用 |
Ⅰ.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3.设计如图1的实验:

(2)SO2水溶液显酸性,用离子方程式说明
(3)甲同学得出的实验结论是干白葡萄酒中不含SO2或H2SO3.这个结论
Ⅱ.实验方案二
用如图实验装置探究二氧化硫的氧化性。按图2充入气体,连接装置,关闭旋塞1和2。

(4)打开旋塞1,可观察到的主要现象是
(5)若A瓶和B瓶的体积相等,恢复到常温,关闭旋塞1,打开旋塞2,可观察到的现象是
(6)若图2装置中充入H2S和SO2的混合气体共1mol,充分反应后,所得氧化产物比还原产物多0.25mol,则原混合气体中H2S和SO2的体积比可能是_______。
A.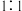 | B. | C.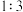 | D. |

在上述实验中,采用铜和浓硫酸制备SO2,应放置在下列

探究二氧化硫的还原性
(8)图2装置中将氢氧化钠溶液换为
(9)将SO2气体通入下列装置中,一定不可能产生沉淀的共

(10)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物HCl和H2SO4。请写出该反应的化学方程式
Ⅲ.实验方案三
搭建图示装置为测定某葡萄酒中SO2的含量:

实验步骤如下:在B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应。除去C中剩余的H2O2后,用0.090 0 mol·L-1 NaOH溶液测定反应生成的酸,消耗NaOH溶液25.00 mL。
(11)C中通入SO2发生反应的化学方程式为
(12)通过计算求出该葡萄酒中SO2的含量(以g·L-1为单位,即每升葡萄酒中含有SO2的质量)
(13)该测定结果比实际值偏高,可能的原因是
(14)针对此原因提出一条改进措施:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】拟用如图装置设计实验来探究纯净、干燥的氯气与氨气的反应。___________ 。
(2)如图中的装置连接顺序为A→___________ (用大写字母表示)。若按照正确顺序连接实验装置后,整套实验装置存在的主要缺点___________ 。
(3)写出F装置中的反应的一种工业用途:___________ 。
(4)在工业上利用反应N2+3H2 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是___________ (填字母)。
A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)

(2)如图中的装置连接顺序为A→
(3)写出F装置中的反应的一种工业用途:
(4)在工业上利用反应N2+3H2
 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐1】化学工作者和广大消费者十分关注聚氯乙烯保险膜的安全问题。工业上用乙烯和氯气为原料经过下列各步反应合成聚氯乙烯:

(1)乙烯是来自石油的重要有机化工原料,目前工业上生产乙烯主要以石油为原料通过_______ 反应来实现。
(2)反应①的化学方程式为:_______ 。
(3)有机物乙是乙炔,结构中的碳碳三键是比碳碳双键更不饱和的键,推测乙炔具有的性质_______ (写出一点即可)。
(4)丙是聚氯乙烯的单体,其结构简式为_______ 。

(1)乙烯是来自石油的重要有机化工原料,目前工业上生产乙烯主要以石油为原料通过
(2)反应①的化学方程式为:
(3)有机物乙是乙炔,结构中的碳碳三键是比碳碳双键更不饱和的键,推测乙炔具有的性质
(4)丙是聚氯乙烯的单体,其结构简式为
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知淀粉、葡萄糖及A、B、C、D、E之间的相互转化关系如图所示。请回答:

(1)B中的官能团名称是____ ,A的结构简式是____ 。
(2)已知C与D发生加成反应生成E,其化学方程式为___ 。
(3)下列说法正确的是____ 。
A. 题中的“某工艺”指的是裂解
B. 可用溴的四氯化碳溶液鉴别B和C
C. E不溶于水,能使酸性高锰酸钾溶液褪色
D. A在热Cu丝催化下可氧化生成相对分子质量比它小2的有机物

(1)B中的官能团名称是
(2)已知C与D发生加成反应生成E,其化学方程式为
(3)下列说法正确的是
A. 题中的“某工艺”指的是裂解
B. 可用溴的四氯化碳溶液鉴别B和C
C. E不溶于水,能使酸性高锰酸钾溶液褪色
D. A在热Cu丝催化下可氧化生成相对分子质量比它小2的有机物
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐3】石油经裂解可获得大量化工产品A,以A为原料合成香料D的流程如下:
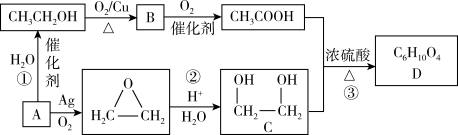
请回答下列问题:
(1)在标准状况下,烃A的密度约为___________ 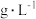 。
。
(2)物质B的官能团的名称为___________ 。
(3)反应②的有机反应类型为___________ 。
(4)写出物质C与金属钠反应的化学方程式___________ 。
(5)T是D的同分异构体,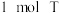 与足量的碳酸氢钠溶液反应能放出
与足量的碳酸氢钠溶液反应能放出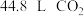 (标准状况下),则T的可能结构有
(标准状况下),则T的可能结构有___________ 种。(不考虑立体异构)

请回答下列问题:
(1)在标准状况下,烃A的密度约为
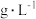 。
。(2)物质B的官能团的名称为
(3)反应②的有机反应类型为
(4)写出物质C与金属钠反应的化学方程式
(5)T是D的同分异构体,
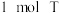 与足量的碳酸氢钠溶液反应能放出
与足量的碳酸氢钠溶液反应能放出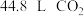 (标准状况下),则T的可能结构有
(标准状况下),则T的可能结构有
您最近一年使用:0次



