酸碱中和反应能设计成原电池。某团队设计的装置如图所示。下列关于该原电池的说法错误的是
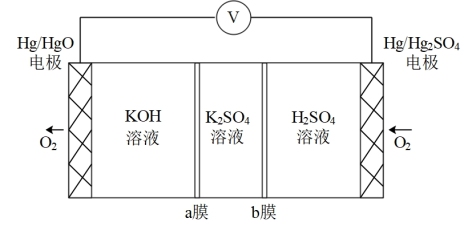

A.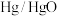 电极的电极反应式为 电极的电极反应式为 |
| B.b膜是阳离子交换膜 |
C.生成 时,放出的电能与 时,放出的电能与 和稀硫酸反应的中和热相等 和稀硫酸反应的中和热相等 |
D.改变 溶液或 溶液或 溶液浓度,电压会发生变化 溶液浓度,电压会发生变化 |
21-22高三下·辽宁沈阳·阶段练习 查看更多[5]
辽宁省沈阳市郊联体2022届高三下学期4月份线上考试化学试题(已下线)化学-2022年高考押题预测卷01(广东卷)(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)(已下线)三轮冲刺卷2-【赢在高考黄金20卷】备战2022年高考化学模拟卷(辽宁专用)湖北省应城市第一中学2022届高三考前押题卷化学试题
更新时间:2022-04-13 16:59:05
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】氢氧燃料电池可用于太空航行中,反应产生的水经冷却后可作为航天员的饮用水。下列关于碱性氢氧燃料电池的说法正确的是
| A.电池工作时,负极电势高于正极电势 |
B.电池工作时,负极的电极反应为: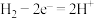 |
| C.电池工作时,正极区附近溶液碱性减弱 |
| D.当得到0.9L饮用水时,转移电子为100mol |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】装置甲为铁镍可充电电池: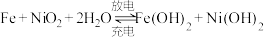 ;装置乙为电解池(两电极均为惰性电极),当闭合开关K时,Y附近溶液先变红。下列说法正确的是
;装置乙为电解池(两电极均为惰性电极),当闭合开关K时,Y附近溶液先变红。下列说法正确的是
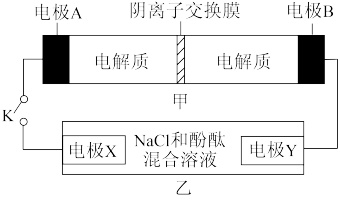
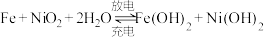 ;装置乙为电解池(两电极均为惰性电极),当闭合开关K时,Y附近溶液先变红。下列说法正确的是
;装置乙为电解池(两电极均为惰性电极),当闭合开关K时,Y附近溶液先变红。下列说法正确的是
| A.闭合K时,Y极发生氧化反应 |
B.闭合K时,A电极反应式为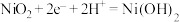 |
| C.理论上,电解一段时间后X极与Y极产生的气体物质的量相等 |
D.装置甲充电时, 通过阴离子交换膜,移向B电极 通过阴离子交换膜,移向B电极 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】控制合适的条件,将反应2Fe3++2I-⇌2Fe2++I2设计成如图所示原电池装置,下列说法正确的是


| A.开始时,甲烧杯中石墨棒是负极 |
| B.该反应处于平衡状态时无电流通过 |
| C.电流计指针归“0”后,甲烧杯中加入FeCl2(s)时,指针再次向右偏转 |
| D.反应达平衡后,甲烧杯中加入FeCl2(s),盐桥中的阴离子向乙烧杯中迁移 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】近期我国科学家报道了一种低成本高储能液流电池,其工作原理如下图。下列说法中错误的是
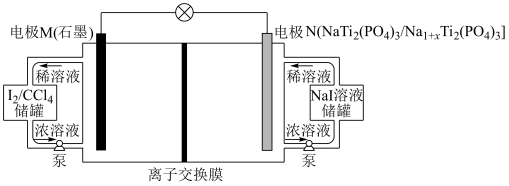
| A.电极M为正极 |
| B.离子交换膜应选用阳离子交换膜 |
C.电极N上发生反应的电极反应为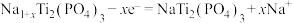 |
D.理论上N电极质量减少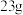 ,电路中转移的电子数目为 ,电路中转移的电子数目为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理如图所示,电池工作前,两极电解质溶液质量相等。下列说法错误的是


| A.该装置实现了太阳能到化学能的转化 |
| B.H+由电极a移向电极b |
| C.b的电极反应式为CO2+2H++2e-=HCOOH |
| D.当电极a生成标准状况下1.12 L O2时,两极电解质溶液质量相差4.6 g |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】用有机电解质组成的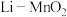 纽扣式电池的结构如图所示。下列说法正确的是
纽扣式电池的结构如图所示。下列说法正确的是
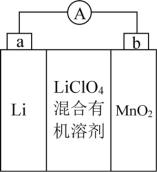
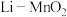 纽扣式电池的结构如图所示。下列说法正确的是
纽扣式电池的结构如图所示。下列说法正确的是
| A.锂电极发生还原反应 |
| B.电池工作时,外电路中电流方向为a→b |
| C.电解质的阴离子向二氧化锰电极移动 |
D.二氧化锰的电极反应式: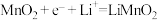 |
您最近一年使用:0次

 和
和 合成
合成 。下列有关说法错误的是
。下列有关说法错误的是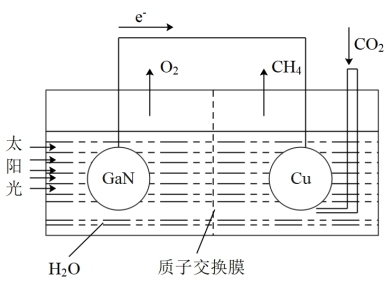
 向Cu电极移动
向Cu电极移动
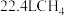 转移8mol电子
转移8mol电子


