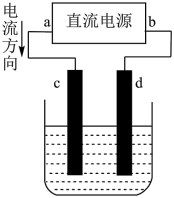
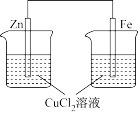关于如图装置所示的两个实验,说法正确的是
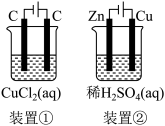

| A.两个装置中都发生了化学变化,都由化学能转变为电能 |
| B.装置②中电流方向是从Zn经导线流入Cu |
| C.反应开始阶段,两个装置中均有氢气产生 |
| D.电极反应式:阳极 2Cl—-2e-→Cl2↑正极 2H++2e-→H2↑ |
13-14高三上·上海金山·期末 查看更多[4]
(已下线)2013届上海市金山区高三上学期期末考试化学试卷(已下线)上海市普陀区2010届高三第二次模拟考试化学试题新疆维吾尔自治区喀什地区巴楚县2022-2023学年高一下学期7月期末化学试题(已下线)合格考汇编12化学反应与能量
更新时间:2016-12-09 04:32:56
|
相似题推荐
单选题
|
容易
(0.94)
名校
【推荐1】下列关于铜、锌、稀H2SO4构成的原电池的有关叙述错误的是( )
| A.在内电路中H+流向铜电极 |
| B.铜为正极,但铜不发生反应 |
| C.负极发生还原反应,正极发生氧化反应 |
| D.外电路中电子由锌电极流向铜电极 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】铜锌原电池装置如图所示,有关说法正确的是
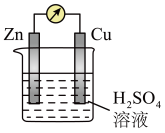

| A.锌片作正极 | B.铜片上产生气泡 |
| C.可将电能转化成化学能 | D.电子由铜片经溶液流向锌片 |
您最近一年使用:0次
单选题
|
容易
(0.94)
解题方法
【推荐1】图为番茄电池,下列说法正确的是
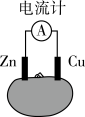

| A.电子由铜通过导线流向锌 |
| B.铜电极附近会出现蓝色 |
| C.一段时间后,锌片质量会变小 |
| D.锌电极是该电池的正极 |
您最近一年使用:0次
单选题
|
容易
(0.94)
解题方法
【推荐2】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是
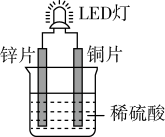

| A.其能量转化的形式主要是:化学能→电能→光能 |
| B.导线中电子的流动方向是:铜片→导线→锌片 |
| C.铜片上发生氧化反应,锌片上发生还原反应 |
| D.电池工作一段时间后,溶液的PH会减小 |
您最近一年使用:0次
单选题
|
容易
(0.94)
【推荐1】水溶液中电解催化还原 制甲酸是实现“碳中和”的途径之一。下列说法正确的是
制甲酸是实现“碳中和”的途径之一。下列说法正确的是
 制甲酸是实现“碳中和”的途径之一。下列说法正确的是
制甲酸是实现“碳中和”的途径之一。下列说法正确的是| A.该过程将化学能转化为电能 |
B.生成甲酸的电极反应为: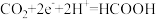 |
| C.阳离子由阴极移向阳极 |
D.电路中通过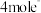 ,阳极生成 ,阳极生成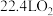 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】下列关于化学反应与能量变化的说法正确的是
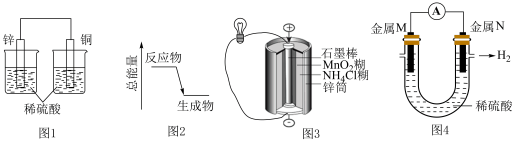
| A.图1所示装置可将化学能转化为电能 |
B.图2可表示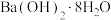 晶体与 晶体与 晶体反应的能量变化 晶体反应的能量变化 |
C.图3所示的锌锰干电池中 在正极发生还原反应 在正极发生还原反应 |
| D.图4所示装置可验证金属活动性:M<N |
您最近一年使用:0次
单选题
|
容易
(0.94)
真题
名校
【推荐1】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:原电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O Al2O3+3H2↑电解过程中,以下判断正确的是
Al2O3+3H2↑电解过程中,以下判断正确的是
 Al2O3+3H2↑电解过程中,以下判断正确的是
Al2O3+3H2↑电解过程中,以下判断正确的是| 电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
| D |  | 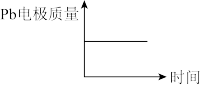 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
容易
(0.94)
解题方法
【推荐2】铅蓄电池是汽车常用的蓄电池,其构造如图所示。下列说法不正确的是
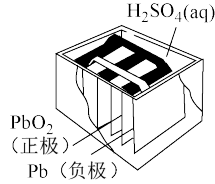

| A.电池充电时总反应为:2PbSO4+2H2O=Pb+PbO2+2H2SO4 |
| B.电池放电时,c(H+)减小 |
| C.电池放电时,负极质量减轻 |
| D.铅蓄电池的缺点是笨重、比能量低 |
您最近一年使用:0次


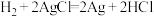 。下列说法正确的是
。下列说法正确的是