NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是


| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3反应速率相等 |
| C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1 |
| D.温度高于40℃时,淀粉不宜用作该实验的指示剂 |
2013·福建·高考真题 查看更多[27]
河北省唐山市丰润区2023-2024学年高二上学期期中考试化学试题福建省莆田第一中学2022-2023学年高二上学期第一学段考试化学试题四川省内江市第六中学2021-2022学年上学期高二第二次月考化学试题(已下线)【南昌新东方】5. 南昌三中 徐钢 吴丹.吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题山西省晋中市祁县中学校2019-2020学年高二11月月考化学试题(已下线)上海市奉贤区2014届高三4月调研测试(二模)化学试题2020届高三化学二轮冲刺新题专练——药品的保存和使用、指示剂试纸的使用河北省张家口市怀来县新保安第二中学2019-2020学年高二上学期11月月考化学试题河北省张家口市宣化一中、张北一中2019-2020学年高二上学期期中联考化学试题江西省南昌市八一中学、洪都中学、十七中三校2019-2020学年高二10月联考化学试题(已下线)2019年9月10日《每日一题》选修4—— 化学反应速率的图像题河南省鹤壁市淇滨高级中学2019-2020学年高二上学期第一次月考化学试题江苏省宝应中学2017-2018学年高二第二学期期中考试化学试题辽宁省沈阳市东北育才学校2018届高三第三次模拟考试化学试题辽宁省大连育明高级中学2018届高三人教版选修四9.13同步测试化学试题2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学反应速率及其影响因素2016-2017学年天津市静海一中高二12月月考化学卷2016-2017学年山西省大同一中高二上10月月考化学卷2016届河北定州中学高三下学期周练二化学试卷2016届河北省定州中学高三下周练(一)化学试卷2016届四川省攀枝花十二中高三下学期第一次月考化学试卷2015-2016学年陕西省西安一中高二上10月月考化学试卷2014-2015学年湖北省武汉市第二中学高一下期末化学试卷2015届安徽省黄山市高三毕业班第二次质量检测理综化学试卷2015届江苏省盐城市时杨中学高三第二次调研考试化学试卷2013年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷)
更新时间:2019-01-30 18:14:09
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】在2L的密闭容器中,发生反应:3A(g)+B(g) 2C(g),若最初加入A和B都是4mol,10s时,反应达到平衡状态,已知0~10s内,v(A)=0.12mol·L-1·s-1。下列说法错误的是
2C(g),若最初加入A和B都是4mol,10s时,反应达到平衡状态,已知0~10s内,v(A)=0.12mol·L-1·s-1。下列说法错误的是
 2C(g),若最初加入A和B都是4mol,10s时,反应达到平衡状态,已知0~10s内,v(A)=0.12mol·L-1·s-1。下列说法错误的是
2C(g),若最初加入A和B都是4mol,10s时,反应达到平衡状态,已知0~10s内,v(A)=0.12mol·L-1·s-1。下列说法错误的是| A.达平衡时B的转化率为20% |
| B.0~10s内,v(C)=0.08mol·L-1·s-1 |
| C.反应过程中,A、B速率关系有v(A)=3v(B) |
| D.其他条件不变,延长反应时间,C的体积分数增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】用如图所示的装置测定不同浓度的稀硫酸与纯铝反应制取H2的反应速率,按照装置图组装3套完全相同的装置(气密性良好).首先将注射器推至最底端,然后在三个锥形瓶中分别放入相同形状的块状纯铝0.9g,最后通过分液漏斗向三个锥形瓶中分别加入0.5mol•L-1、1.0mol•L-1和2.0mol•L-1的稀硫酸各40mL(忽略溶液体积的变化及反应温度的影响).

下列说法错误的是

| 实验 | 加入的稀硫酸的浓度 | 反应时间/min | 收集到的气体/mL | 反应速率/(mL•min-1) |
| ① | 0.5mol•L-1 | 15 | 18 | v1 |
| ② | 1.0mol•L-1 | t1 | 18 | v2 |
| ③ | 2.0mol•L-1 | t2 | 18 | 12 |
| A.实验①测得H2的反应速率为0.02mL•s-1 |
| B.实验②中反应结束后,生成H2的体积在标准状况下为1120mL |
| C.实验②中t1的取值范围为1.5<t1<15 |
| D.实验③中,若将块状纯铝碾碎成粉末,反应开始至收集到相同体积的气体时,反应速率一定大于12mL•min-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】据文献报道: 催化某反应的一种反应机理如下图所示。下列叙述错误的是
催化某反应的一种反应机理如下图所示。下列叙述错误的是
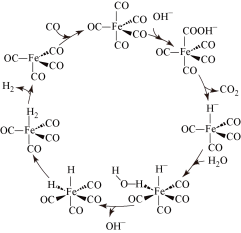
 催化某反应的一种反应机理如下图所示。下列叙述错误的是
催化某反应的一种反应机理如下图所示。下列叙述错误的是
A. 参与了该催化循环 参与了该催化循环 | B. 可加快该反应的速率 可加快该反应的速率 |
| C.该反应有利于实现碳中和 | D.该催化循环中Fe的成键数目发生变化 |
您最近一年使用:0次
单选题
|
适中
(0.64)
名校
【推荐2】在密闭容器中进行的反应:N2+3H2 2NH3,下列说法正确的是
2NH3,下列说法正确的是
 2NH3,下列说法正确的是
2NH3,下列说法正确的是| A.加入催化剂能加快反应速率 |
| B.增大压强能减慢反应速率 |
| C.达到平衡时,反应速率:v(正) = v(逆) = 0 |
| D.达到平衡时,N2和H2能100%转化为NH3 |
您最近一年使用:0次

 ,
, 。常温下,向一定体积的自来水中加入离子交换树脂(NaR),测得自来水中
。常温下,向一定体积的自来水中加入离子交换树脂(NaR),测得自来水中 变化如图所示。下列叙述正确的是
变化如图所示。下列叙述正确的是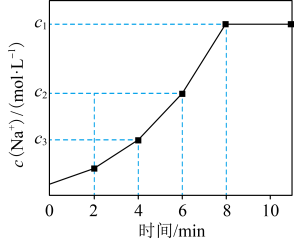
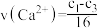 mol⋅L
mol⋅L ⋅min
⋅min 还原
还原 可制备金属铁,其反应原理为
可制备金属铁,其反应原理为 。在不同温度(
。在不同温度( 、
、 )下,向装有足量
)下,向装有足量 恒容密闭容器中通入
恒容密闭容器中通入
 的体积分数
的体积分数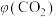 随时间
随时间 的变化曲线如图所示。下列说法正确的是
的变化曲线如图所示。下列说法正确的是


 从反应体系中移走可提高
从反应体系中移走可提高

