某化学小组用50mL0.50mol•L-1NaOH溶液和30mL0.50mol•L-1硫酸溶液进行中和热的测定实验(实验装置如图所示)。

(1)实验中大约要使用230mLNaOH溶液,配制溶液时至少需要称量NaOH固体____ g。
(2)图中尚缺少的一种仪器是____ 。
(3)实验时环形玻璃搅拌棒的运动方向是____ 。
a.上下运动 b.左右运动 c.顺时针运动 d.逆时针运动
(4)他们记录的实验数据如表:
①请填写表中的空白:
②已知:溶液的比热容c为4.18J•g-1•℃-1,溶液的密度均为1g•cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:____ (用该实验的数据计算ΔH,取小数点后一位)。

(1)实验中大约要使用230mLNaOH溶液,配制溶液时至少需要称量NaOH固体
(2)图中尚缺少的一种仪器是
(3)实验时环形玻璃搅拌棒的运动方向是
a.上下运动 b.左右运动 c.顺时针运动 d.逆时针运动
(4)他们记录的实验数据如表:
①请填写表中的空白:
| 实验次数 | 反应物的温度T1/℃ | 生成物的温度T2/℃ | 温度差平均值(T2-T1)/℃ | |
| H2SO4 | NaOH | |||
| 1 | 25.0 | 25.0 | 29.1 | ΔT= |
| 2 | 25.0 | 25.0 | 29.8 | |
| 3 | 25.0 | 25.0 | 28.9 | |
| 4 | 25.0 | 25.0 | 29.0 | |
更新时间:2022-09-21 16:48:19
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
【推荐1】50mL0.5mol·L-1盐酸跟50 mL0.55mol·L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)实验目的:_____ 。
(2)实验用品:烧杯(500mL和100mL各1只)、温度计、塑料泡沫板(或硬纸板)、泡沫塑料或纸条、____ (填写所缺的实验仪器);0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液
(3)实验步骤:(略)
(4)问题与结论:
①完整地做一次这样的实验,需测定____ 次温度。
②大、小烧杯间填满碎纸条、大烧杯上加盖硬纸板的作用是_____ 。
③该实验中NaOH溶液的浓度大于盐酸浓度的作用是____ 。
④改用60mL1.0mol·L-1盐酸跟50mL1.1mol·L-1NaOH溶液进行反应,与上述实验相比,所放热量是否相等:___ (填相等或不等),所求中和热数值是否相等:___ (填相等或不等)。
(1)实验目的:
(2)实验用品:烧杯(500mL和100mL各1只)、温度计、塑料泡沫板(或硬纸板)、泡沫塑料或纸条、
(3)实验步骤:(略)
(4)问题与结论:
①完整地做一次这样的实验,需测定
②大、小烧杯间填满碎纸条、大烧杯上加盖硬纸板的作用是
③该实验中NaOH溶液的浓度大于盐酸浓度的作用是
④改用60mL1.0mol·L-1盐酸跟50mL1.1mol·L-1NaOH溶液进行反应,与上述实验相比,所放热量是否相等:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。实验数据如下表:

近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是________ ,烧杯间填满碎泡沫塑料的作用是_____________ 。大烧杯上如不盖硬纸板,则求得的中和热数值_______ (填“偏大” “偏小”或“无影响”)。则中和热ΔH=________ (取小数点后一位)。
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |

近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1HCl溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】实验题
(1)中和热测定:
①某实验小组用100mL 0.50 mol∙L−1 NaOH溶液与60mL 0.50 mol∙L−1硫酸进行中和热的测定。装置如图所示,回答下列问题:

图中装置缺少的仪器是___________ 。
②请根据下表中的数据计算实验中和热,近似认为0.50 mol∙L−1 NaOH溶液与0.50 mol∙L−1硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容为c=4.18J/(g∙℃)则上述实验中和热ΔH=___________ (取小数点后一位)
附:中和热的计算公式:ΔH= − kJ·mol-1
kJ·mol-1
③上述实验结果与中和热ΔH= −57.3 kJ∙mol−1有偏差,产生偏差的原因可能是___________
A.量取NaOH溶液时俯视读数 B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差 D.用铜丝代替玻璃棒搅拌
(2)酸碱中和滴定:室温下,向20.00mL0.1000 mol∙L−1盐酸中滴加0.1000 mol∙L−1NaOH溶液,溶液的pH随NaOH溶液体积的变化如图2.(已知lg2=0.3)

①根据滴定曲线,V(NaOH)=30.00mL时,pH=___________ 。(溶液体积变化忽略不计)
②下列关于滴定分析,正确的是___________ 。
A.滴定前,锥形瓶和滴定管均须用标准溶液润洗
B.根据滴定曲线可知,选择甲基红指示反应终点,误差比甲基橙的小
C.当25ml滴定管的液面位于0刻度时,滴定管中的液体体积刚为25.00ml
D.滴定时,通常用左手挤压玻璃珠稍上处,右手摇动锥形瓶,使溶液向同一方向旋转
③滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→___________ →___________ →___________ →___________ →记录起始数据→开始滴定。
A.调整滴定液液面至零刻度或零刻度以下
B.装入滴定液至零刻度以上
C.烘干
D.用洗耳球吹出润洗液
E.用滴定液润洗2至3次
F.排除气泡
④若开始滴定前,滴定管尖悬挂的液滴未擦去,则测定的结果___________ (填“偏大”、“偏小”或“无影响”)。若滴定结束时仰视读数,则测定的结果___________ (填“偏大”、“偏小”或“无影响”)。
(1)中和热测定:
①某实验小组用100mL 0.50 mol∙L−1 NaOH溶液与60mL 0.50 mol∙L−1硫酸进行中和热的测定。装置如图所示,回答下列问题:

图中装置缺少的仪器是
②请根据下表中的数据计算实验中和热,近似认为0.50 mol∙L−1 NaOH溶液与0.50 mol∙L−1硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容为c=4.18J/(g∙℃)则上述实验中和热ΔH=
附:中和热的计算公式:ΔH= −
 kJ·mol-1
kJ·mol-1| 实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | ||
| HCl | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
A.量取NaOH溶液时俯视读数 B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差 D.用铜丝代替玻璃棒搅拌
(2)酸碱中和滴定:室温下,向20.00mL0.1000 mol∙L−1盐酸中滴加0.1000 mol∙L−1NaOH溶液,溶液的pH随NaOH溶液体积的变化如图2.(已知lg2=0.3)

①根据滴定曲线,V(NaOH)=30.00mL时,pH=
②下列关于滴定分析,正确的是
A.滴定前,锥形瓶和滴定管均须用标准溶液润洗
B.根据滴定曲线可知,选择甲基红指示反应终点,误差比甲基橙的小
C.当25ml滴定管的液面位于0刻度时,滴定管中的液体体积刚为25.00ml
D.滴定时,通常用左手挤压玻璃珠稍上处,右手摇动锥形瓶,使溶液向同一方向旋转
③滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→
A.调整滴定液液面至零刻度或零刻度以下
B.装入滴定液至零刻度以上
C.烘干
D.用洗耳球吹出润洗液
E.用滴定液润洗2至3次
F.排除气泡
④若开始滴定前,滴定管尖悬挂的液滴未擦去,则测定的结果
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】实验室用50mL 0.50 mol∙L−1盐酸、50mL 0.55 mol∙L−1NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

(1)实验时还需要用的仪器是__________ 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是__________ 。
(3)根据上表中所测数据进行计算,则该实验测得的中和热∆H=___________ [盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g•℃)计算]。
(4)如用0.5 mol∙L−1的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将___________ (填“偏大”、“偏小”、“不变”)。如改用60mL 0.5 mol∙L−1的盐酸与50mL 0.55 mol∙L−1的NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”或“不相等”),所求中和热___________ (填“相等”或“不相等”)。
(5)上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)___________ 。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取NaOH溶液时仰视计数
E.大烧杯的盖扳中间小孔太大。

(1)实验时还需要用的仪器是
(2)在操作正确的前提下,提高中和热测定准确性的关键是
| 实验次数 | 起始温度/t1℃ | 终止温度/t2℃ | |
| 盐酸 | 氢氧化钠溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(4)如用0.5 mol∙L−1的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将
(5)上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取NaOH溶液时仰视计数
E.大烧杯的盖扳中间小孔太大。
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】用下图装置测定中和热

实验药品: 盐酸、
盐酸、 溶液、
溶液、 氨水。
氨水。
实验步骤:略。
回答下列问题:
(1)若实验共需要 溶液,实验室在配制该溶液时,则需要称量
溶液,实验室在配制该溶液时,则需要称量 固体
固体_______ g。
(2)从实验装置上看,还缺少_______ ;是否可以用铜质材料替代_______ (填“是”或“否”),理由是_______ 。
(3)烧杯间填满碎泡沫塑料的作用是_______ 。
(4)浓度为 的盐酸溶液和
的盐酸溶液和 的碱溶液各
的碱溶液各 混合(溶液密度均为
混合(溶液密度均为 ),生成溶液的比热容
),生成溶液的比热容 ,搅动后,测得酸碱混合液的温度变化数据如下:
,搅动后,测得酸碱混合液的温度变化数据如下:
①某同学利用上述装置做甲组实验,测得中和热
_______ (保留三位小数),数值明显偏低,试分析可能的原因_______ 。
A.做本实验的当天室温较高
B.测量完盐酸的温度再次测量 溶液温度时,温度计上残留的酸液未用水冲洗干净
溶液温度时,温度计上残留的酸液未用水冲洗干净
C.大小烧杯口不平齐,小烧杯口未接触泡沫塑料板
D. 溶液一次性迅速倒入
溶液一次性迅速倒入
②两组实验结果差异的原因是_______ 。

实验药品:
 盐酸、
盐酸、 溶液、
溶液、 氨水。
氨水。实验步骤:略。
回答下列问题:
(1)若实验共需要
 溶液,实验室在配制该溶液时,则需要称量
溶液,实验室在配制该溶液时,则需要称量 固体
固体(2)从实验装置上看,还缺少
(3)烧杯间填满碎泡沫塑料的作用是
(4)浓度为
 的盐酸溶液和
的盐酸溶液和 的碱溶液各
的碱溶液各 混合(溶液密度均为
混合(溶液密度均为 ),生成溶液的比热容
),生成溶液的比热容 ,搅动后,测得酸碱混合液的温度变化数据如下:
,搅动后,测得酸碱混合液的温度变化数据如下: | 反应物 | 起始温度 | 终止温度 | 中和热 | |
| 甲组 |  | 15.0 | 18.3 |  |
| 乙组 |  | 15.0 | 18.1 |  |

A.做本实验的当天室温较高
B.测量完盐酸的温度再次测量
 溶液温度时,温度计上残留的酸液未用水冲洗干净
溶液温度时,温度计上残留的酸液未用水冲洗干净C.大小烧杯口不平齐,小烧杯口未接触泡沫塑料板
D.
 溶液一次性迅速倒入
溶液一次性迅速倒入②两组实验结果差异的原因是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】通过测定反应过程中所放出的热量可计算中和热。50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________ .
(2)大烧杯上如果不盖硬纸板,求得的中和热数值__________ (填“偏大”,“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热________ (填“相等”“不相等”),简述理由:______________________ .
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,写出表示盐酸与NaOH溶液反应的中和热的热化学方程式________________________ .(小数点后保留一位小数)

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)大烧杯上如果不盖硬纸板,求得的中和热数值
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,写出表示盐酸与NaOH溶液反应的中和热的热化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】实验室配制500mL 0.2mol/L Na2SO4溶液,所需仪器有____________ ;若实验操作中某同学在加蒸馏水至刻度线时仰视观察确定蒸馏水的加入量,则所配溶液浓度_________ (选填“偏高”“偏低”或“无影响”)。
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】用硫铁矿烧渣(主要成分为 和少量
和少量 )为原料可以制得绿矾(
)为原料可以制得绿矾( )产品,其制备流程如下。
)产品,其制备流程如下。
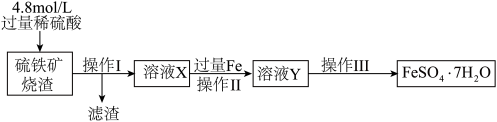
已知: 不能与稀硫酸反应。
不能与稀硫酸反应。
Ⅰ、配制250mL4.8mol/L的稀硫酸溶液
(1)需要用到的玻璃仪器主要是量筒、烧杯、玻璃棒、胶头滴管和___________ (填仪器名称)。
(2)下列操作会引起结果偏高的是___________(选填字母序号)。
Ⅱ、绿矾的制备流程图中
(3)工艺生产中,常将硫铁矿烧渣粉碎,这样做的目的是___________ 。
(4)往溶液X中加过量铁粉时,溶液颜色由棕黄色变为浅绿色且有气泡产生,该过程中反应的离子方程式为___________ 和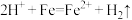 。
。
(5)操作Ⅲ指的是蒸发浓缩、___________ (填操作名称)、过滤、洗涤、干燥。检验溶液Y是否含有 的试剂是
的试剂是___________ (选填字母编号)。
A.KSCN溶液 B.酸性 溶液 C.新制氯水
溶液 C.新制氯水
(6)充分灼烧15.0g绿矾产品,可得到4.0g某种红棕色固体。则该红棕色固体是___________ ,该绿矾产品的纯度为___________ (结果保留一位小数)。
 和少量
和少量 )为原料可以制得绿矾(
)为原料可以制得绿矾( )产品,其制备流程如下。
)产品,其制备流程如下。
已知:
 不能与稀硫酸反应。
不能与稀硫酸反应。Ⅰ、配制250mL4.8mol/L的稀硫酸溶液
(1)需要用到的玻璃仪器主要是量筒、烧杯、玻璃棒、胶头滴管和
(2)下列操作会引起结果偏高的是___________(选填字母序号)。
| A.未洗涤玻璃棒 | B.容量瓶未干燥,含有少量蒸馏水 |
| C.摇匀后液面下降,补充水 | D.定容时俯视刻度线 |
Ⅱ、绿矾的制备流程图中
(3)工艺生产中,常将硫铁矿烧渣粉碎,这样做的目的是
(4)往溶液X中加过量铁粉时,溶液颜色由棕黄色变为浅绿色且有气泡产生,该过程中反应的离子方程式为
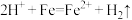 。
。(5)操作Ⅲ指的是蒸发浓缩、
 的试剂是
的试剂是A.KSCN溶液 B.酸性
 溶液 C.新制氯水
溶液 C.新制氯水(6)充分灼烧15.0g绿矾产品,可得到4.0g某种红棕色固体。则该红棕色固体是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】硫酸铜是一种具有很多用途的化学物质,在工业领域(涂料工业、印染工业及有机工业)和农业领域(配制杀菌剂)都有广泛应用。现用胆矾(CuSO4·5H2O,式量为250)为原料配制220mL浓度为0.2mol/L的硫酸钾溶液。
(1)在实验过程中,选用最合适的容量瓶为___________ 。
A.200mL容量瓶B.250mL容量瓶C.500mL容量瓶
(2)容量瓶上标有___________ 。(填字母)
①温度②物质的量浓度③容积④压强⑤刻度线
A.①③⑤B.①③④C.②④D.②④⑤
(3)通过计算,应该使用托盘天平称取胆矾___________ g。
(4)下列操作会使所配溶液浓度偏高的是___________ 。
①实验前,容量瓶用蒸馏水洗涤后未用标准液润洗;
②所用的胆矾晶体由于保存不善,导致失去部分结晶水;
③溶解时,不小心有少量溶液溅出;
④移液后,洗涤烧杯和玻璃棒2-3次,并将洗涤液也移入容量瓶;
⑤定容时,俯视液面;
⑥摇匀后,发现液面低于刻度线,又加水至刻度线。
(5)将蓝色胆矾晶体加热会逐步失去结晶水,最终变为白色的硫酸铜粉末,则该变化过程为___________ 变化(填“物理”或“化学”)。
(1)在实验过程中,选用最合适的容量瓶为
A.200mL容量瓶B.250mL容量瓶C.500mL容量瓶
(2)容量瓶上标有
①温度②物质的量浓度③容积④压强⑤刻度线
A.①③⑤B.①③④C.②④D.②④⑤
(3)通过计算,应该使用托盘天平称取胆矾
(4)下列操作会使所配溶液浓度偏高的是
①实验前,容量瓶用蒸馏水洗涤后未用标准液润洗;
②所用的胆矾晶体由于保存不善,导致失去部分结晶水;
③溶解时,不小心有少量溶液溅出;
④移液后,洗涤烧杯和玻璃棒2-3次,并将洗涤液也移入容量瓶;
⑤定容时,俯视液面;
⑥摇匀后,发现液面低于刻度线,又加水至刻度线。
(5)将蓝色胆矾晶体加热会逐步失去结晶水,最终变为白色的硫酸铜粉末,则该变化过程为
您最近一年使用:0次



