合成氨工业涉及固体燃料的气化,需要研究 与
与 之间的转化。为了弄清其规律,让一定量的
之间的转化。为了弄清其规律,让一定量的 与足量碳在体积可变的密闭容器中反应:
与足量碳在体积可变的密闭容器中反应: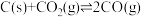
 ,测得压强、温度对
,测得压强、温度对 、
、 的平衡组成的影响如图所示,回答下列问题:
的平衡组成的影响如图所示,回答下列问题:
(1) 、
、 、
、 的大小关系是
的大小关系是_______ ,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为_______ 。图中a、b、c三点对应的平衡常数大小关系是_______ 。
(2)一定条件下,在 与足量碳反应所得平衡体系中加入
与足量碳反应所得平衡体系中加入 和适当催化剂,有下列反应发生:
和适当催化剂,有下列反应发生:
反应1: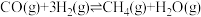
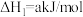
反应2: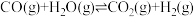
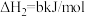
①则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是_______ 。
②已知 时相关化学键键能数据为:
时相关化学键键能数据为:
根据键能计算,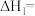
_______ 。
 与
与 之间的转化。为了弄清其规律,让一定量的
之间的转化。为了弄清其规律,让一定量的 与足量碳在体积可变的密闭容器中反应:
与足量碳在体积可变的密闭容器中反应: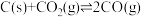
 ,测得压强、温度对
,测得压强、温度对 、
、 的平衡组成的影响如图所示,回答下列问题:
的平衡组成的影响如图所示,回答下列问题:
(1)
 、
、 、
、 的大小关系是
的大小关系是(2)一定条件下,在
 与足量碳反应所得平衡体系中加入
与足量碳反应所得平衡体系中加入 和适当催化剂,有下列反应发生:
和适当催化剂,有下列反应发生:反应1:
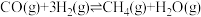
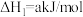
反应2:
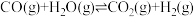
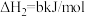
①则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是
②已知
 时相关化学键键能数据为:
时相关化学键键能数据为:| 化学键 | H-H | O-H | C-H | C≡O |
 | 436 | 465 | 413 | 1076 |
根据键能计算,
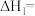
更新时间:2022/10/26 19:42:46
|
【知识点】 化学反应原理综合考查解读
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】我国科研人员成功研制出一条从二氧化碳合成淀粉的途径,其中第一步为 ,为推进“碳达峰”和“碳中和”目标实现的技术路线提供了一种新思路。
,为推进“碳达峰”和“碳中和”目标实现的技术路线提供了一种新思路。
(1)计算机模拟该反应的反应历程如下图所示,其中吸附在催化剂上面的物质用“*”标注,“TS”表示过渡状态。

①

_______  。
。
②该反应历程中反应速率最快步骤的化学方程式为_______ 。
(2)实验研究表明,其他条件相同时,使用分子筛(分子筛能选择性分离出水蒸气)能有效提高甲醇的平衡产率,其原因是_______ 。
(3)540K下,分别按初始投料比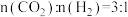 ,
,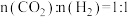 ,
, 进行该反应,得到不同压强下
进行该反应,得到不同压强下 的平衡转化率关系如图甲:
的平衡转化率关系如图甲:

①投料比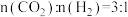 的曲线为
的曲线为_______ (填“a”、“b”或“c”)。
②该反应压强平衡常数的表达式
_______ 0(用平衡分压代替平衡浓度)。
③已知540K下该反应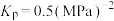 ,某时刻测得某容器内
,某时刻测得某容器内 ,
, ,
,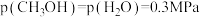 ,此时v(正)
,此时v(正)_______ v(逆)(填“>”、“=”或“<”)。
(4)目前,科研人员在研究光电催化 还原为甲醇的领域也取得了一定的进展,其原理如图乙所示,则生成甲醇的电极反应式为
还原为甲醇的领域也取得了一定的进展,其原理如图乙所示,则生成甲醇的电极反应式为_______ 。

 ,为推进“碳达峰”和“碳中和”目标实现的技术路线提供了一种新思路。
,为推进“碳达峰”和“碳中和”目标实现的技术路线提供了一种新思路。(1)计算机模拟该反应的反应历程如下图所示,其中吸附在催化剂上面的物质用“*”标注,“TS”表示过渡状态。

①


 。
。②该反应历程中反应速率最快步骤的化学方程式为
(2)实验研究表明,其他条件相同时,使用分子筛(分子筛能选择性分离出水蒸气)能有效提高甲醇的平衡产率,其原因是
(3)540K下,分别按初始投料比
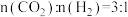 ,
,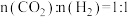 ,
, 进行该反应,得到不同压强下
进行该反应,得到不同压强下 的平衡转化率关系如图甲:
的平衡转化率关系如图甲:
①投料比
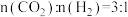 的曲线为
的曲线为②该反应压强平衡常数的表达式

③已知540K下该反应
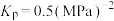 ,某时刻测得某容器内
,某时刻测得某容器内 ,
, ,
,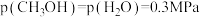 ,此时v(正)
,此时v(正)(4)目前,科研人员在研究光电催化
 还原为甲醇的领域也取得了一定的进展,其原理如图乙所示,则生成甲醇的电极反应式为
还原为甲醇的领域也取得了一定的进展,其原理如图乙所示,则生成甲醇的电极反应式为
您最近一年使用:0次
【推荐2】氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一
I.NO和CO气体均为汽车尾气的成分,目前降低尾气的可行方法是在汽车排气管上安装催化转化器,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知反应中相关键能数据如下:
(1)由此计算△H=__________ 。
(2)在一定温度下,将2.0molNO、2.4molCO通入到容积固定为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
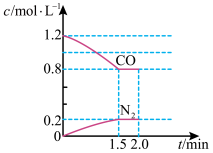
①有害气体NO的转化率为__________ 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是__________ (填序号)。
a.缩小容器体积 b.催化剂 c.降低温度 d.再通入2.0molNO
③ 若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,平衡将__________ (填“正向” 或“逆向”)移动。
Ⅱ.SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) △H<0
(3)该法可能发生副反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ,减少副反应的主要措施是
4NO(g)+6H2O(g) ,减少副反应的主要措施是___________ (写一条即可)。
(4)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。
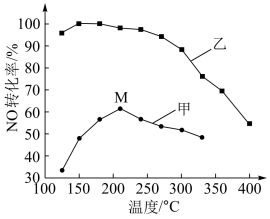
①工业上选择催化剂__________ (填“甲”或“乙”),原因是____________ 。
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率______ (填“可能是”、“一定是”或“一定不是”) 该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是__________ 。(写一条即可)
I.NO和CO气体均为汽车尾气的成分,目前降低尾气的可行方法是在汽车排气管上安装催化转化器,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H已知反应中相关键能数据如下:
| 化学键 | C O O | N≡O | N≡N | C=O |
| 键能/kJ·mol-1 | 1076 | 632 | 946 | 750 |
(2)在一定温度下,将2.0molNO、2.4molCO通入到容积固定为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是
a.缩小容器体积 b.催化剂 c.降低温度 d.再通入2.0molNO
③ 若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,平衡将
Ⅱ.SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) △H<0
(3)该法可能发生副反应4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ,减少副反应的主要措施是
4NO(g)+6H2O(g) ,减少副反应的主要措施是(4)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。

①工业上选择催化剂
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。甲醇是一种可再生能源,具有广泛的开发和应用前景:工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) ΔH1=-116kJ•mol-1。
(1)已知:CO(g)+ O2(g)=CO2(g) ΔH2=-283kJ•mol-1,H2(g)+
O2(g)=CO2(g) ΔH2=-283kJ•mol-1,H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ•mol-1。则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
O2(g)=H2O(g) ΔH3=-242kJ•mol-1。则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为_____ 。
(2)下列措施中有利于增大反应:CO(g)+2H2(g) CH3OH(g)的反应速率且利于反应正向进行的是
CH3OH(g)的反应速率且利于反应正向进行的是_____ 。
(3)恒温条件下,可逆反应:CO(g)+2H2(g) CH3OH(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是
CH3OH(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是_____ 。
A.单位时间内生成nmolCH3OH的同时生成2nmolH2
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E.CO、H2、CH3OH浓度之比为1:2:1的状态。
(4)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:

①A、B、C三点平衡常数KA、KB、KC的大小关系是_____ 。
②压强p1_____ p2(填“>”“<”或“=”),若p2=100kPa,则B点的Kp=_____ kPa-2(Kp为以分压表示的平衡常数;分压=总压×物质的量分数)
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:v正_____ v逆(填“>”“<”或“=”)。
(1)已知:CO(g)+
 O2(g)=CO2(g) ΔH2=-283kJ•mol-1,H2(g)+
O2(g)=CO2(g) ΔH2=-283kJ•mol-1,H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ•mol-1。则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
O2(g)=H2O(g) ΔH3=-242kJ•mol-1。则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为(2)下列措施中有利于增大反应:CO(g)+2H2(g)
 CH3OH(g)的反应速率且利于反应正向进行的是
CH3OH(g)的反应速率且利于反应正向进行的是| A.随时将CH3OH与反应混合物分离 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.使用高效催化剂 |
 CH3OH(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是
CH3OH(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是A.单位时间内生成nmolCH3OH的同时生成2nmolH2
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E.CO、H2、CH3OH浓度之比为1:2:1的状态。
(4)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
①A、B、C三点平衡常数KA、KB、KC的大小关系是
②压强p1
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:v正
您最近一年使用:0次



