下图是化学实验室浓盐酸试剂标签上的部分内容。

(1)写出工业上制HCl的化学方程式_______ ,在实验室中进行该反应,现象是_______
(2)该盐酸的物质的量浓度为_______ ,
(3)同学计划用该浓盐酸配制 的稀盐酸,现实验需要稀盐酸470 mL,可供选用的仪器有:
的稀盐酸,现实验需要稀盐酸470 mL,可供选用的仪器有:
A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E玻璃棒。
①配制稀盐酸时,选择的仪器有:_______ (填序号),还缺少的仪器有_______ 。
②经计算,配制 的稀盐酸需要用量筒量取上述浓盐酸的体积为
的稀盐酸需要用量筒量取上述浓盐酸的体积为_______ mL。
③测定所配制的稀盐酸,发现其浓度大于 ,引起误差的原因可能是
,引起误差的原因可能是_______ 。
A.量取浓盐酸时俯视刻度线
B.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入容量瓶
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶刻度线
E.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(4)现有该浓盐酸100g,需要加入一定量的水将其物质的量浓度稀释为原来的1/2,则加入水的体积是_______ 。
A.大于100 mL B.小于100 mL C.等于100 mL

(1)写出工业上制HCl的化学方程式
(2)该盐酸的物质的量浓度为
(3)同学计划用该浓盐酸配制
 的稀盐酸,现实验需要稀盐酸470 mL,可供选用的仪器有:
的稀盐酸,现实验需要稀盐酸470 mL,可供选用的仪器有:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E玻璃棒。
①配制稀盐酸时,选择的仪器有:
②经计算,配制
 的稀盐酸需要用量筒量取上述浓盐酸的体积为
的稀盐酸需要用量筒量取上述浓盐酸的体积为③测定所配制的稀盐酸,发现其浓度大于
 ,引起误差的原因可能是
,引起误差的原因可能是A.量取浓盐酸时俯视刻度线
B.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入容量瓶
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶刻度线
E.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(4)现有该浓盐酸100g,需要加入一定量的水将其物质的量浓度稀释为原来的1/2,则加入水的体积是
A.大于100 mL B.小于100 mL C.等于100 mL
更新时间:2022-12-07 12:51:00
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】将一定量的NaOH和Na2CO3混合并配成溶液,向溶液中滴加0.1mol•L−1稀盐酸。加入盐酸的体积和生成CO2的物质的量的关系如图所示,请回答下列问题:
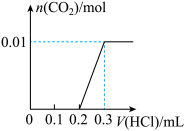
(1)该实验需要配制450mL、0.1mol•L−1的稀盐酸。除了需要用到量筒、烧杯、胶头滴管之外,还需要用到的玻璃仪器是___ 。
(2)若用浓度为10mol•L-1的盐酸来配制0.1mol•L-1稀盐酸,需要量取该盐酸___ mL。
(3)据图所示,当加入盐酸体积0.2~0.3L时的离子方程式为___ 。
(4)根据已知数据可知混合溶液中NaOH的物质的量为___ mol。

(1)该实验需要配制450mL、0.1mol•L−1的稀盐酸。除了需要用到量筒、烧杯、胶头滴管之外,还需要用到的玻璃仪器是
(2)若用浓度为10mol•L-1的盐酸来配制0.1mol•L-1稀盐酸,需要量取该盐酸
(3)据图所示,当加入盐酸体积0.2~0.3L时的离子方程式为
(4)根据已知数据可知混合溶液中NaOH的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】硫酸的工业制取原理为① ,②
,②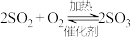 ,③
,③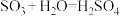 。请回答下列问题:
。请回答下列问题:
(1)请配平反应①的化学方程式:_______
 。
。
(2)标准状况下,
 的摩尔质量为
的摩尔质量为_______ ,质量为_______ g。
(3) 、120℃下,等质量的
、120℃下,等质量的 和
和 的物质的量之比为
的物质的量之比为_______ ,密度之比为_______ 。
(4)质量分数为98%的浓硫酸(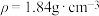 )的物质的量浓度为
)的物质的量浓度为_______  ;实验室需要配制
;实验室需要配制
 硫酸溶液,需要用量筒量取该浓硫酸的体积为
硫酸溶液,需要用量筒量取该浓硫酸的体积为_______ mL;若从配制好的硫酸溶液中取出 ,其浓度为
,其浓度为_______  ,将这
,将这 硫酸溶液稀释至
硫酸溶液稀释至 ,溶液中
,溶液中 浓度为
浓度为_______  。
。
 ,②
,②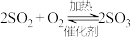 ,③
,③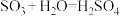 。请回答下列问题:
。请回答下列问题:(1)请配平反应①的化学方程式:
 。
。(2)标准状况下,

 的摩尔质量为
的摩尔质量为(3)
 、120℃下,等质量的
、120℃下,等质量的 和
和 的物质的量之比为
的物质的量之比为(4)质量分数为98%的浓硫酸(
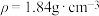 )的物质的量浓度为
)的物质的量浓度为 ;实验室需要配制
;实验室需要配制
 硫酸溶液,需要用量筒量取该浓硫酸的体积为
硫酸溶液,需要用量筒量取该浓硫酸的体积为 ,其浓度为
,其浓度为 ,将这
,将这 硫酸溶液稀释至
硫酸溶液稀释至 ,溶液中
,溶液中 浓度为
浓度为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】NaCl是一种化工原料,可以制备多种物质,如下图所示。
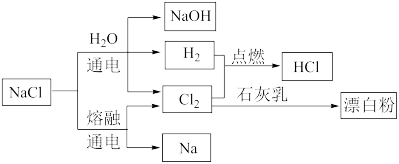
回答问题:
(1)氯化钠溶液通电后,发生反应的离子方程式为_____ ,氢气在氯气中燃烧的现象是_____ 。
(2)氯气通入石灰乳中制取漂白粉的离子方程式为_____ ,从氧化剂、还原剂的角度分析,该反应中氯气的作用是____ 。
(3)漂白粉的有效成分是_____ (填化学式),漂白粉久置于空气中会变质,用化学方程式描述其变质的原因____ 。

回答问题:
(1)氯化钠溶液通电后,发生反应的离子方程式为
(2)氯气通入石灰乳中制取漂白粉的离子方程式为
(3)漂白粉的有效成分是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】同学们为探究卤素单质氧化性的强弱,进行了以下实验。请填写下列空白。
(1)实验一:向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置。观察到液体分为两层,下层呈___ 色。有关反应的化学方程式是________ ,其中的氧化剂是_____ 。
(2)实验二:向盛有少量碘化钠的试管中滴加少量_____ ,振荡,再加入四氯化碳,振荡后静置。观察到液体分为两层,下层呈_____ 色。由此得出的结论是_______________ 。
(3)综合以上两个实验,最终得出的结论是_______________ 。
(4)小明提出可将氟气通入氯化钠溶液中,若观察到有气泡冒出,即可证明氟气的氧化性强于氯气。同学们认为此方案不行,理由是_______________ 。
(1)实验一:向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置。观察到液体分为两层,下层呈
(2)实验二:向盛有少量碘化钠的试管中滴加少量
(3)综合以上两个实验,最终得出的结论是
(4)小明提出可将氟气通入氯化钠溶液中,若观察到有气泡冒出,即可证明氟气的氧化性强于氯气。同学们认为此方案不行,理由是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】资料:“84”消毒液中含氯微粒主要有ClO-、Cl-、HClO,相同浓度时,HClO的氧化性强于ClO-。通常情况下,应将“84”消毒液原液稀释后使用,一般不用于衣服等纺织品的洗涤消毒。
(1)常温,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为_______ 。
(2)已知某“84”消毒液瓶体部分标签如图所示,请回答下列问题。
①该“84”消毒液的物质的量浓度为_______ mol/L。
②“84”消毒液使用时需要稀释,某小组用上述“84”消毒液配制500 mL 0.2mol/L的稀溶液,需要用量筒量取该“84”消毒液体积为_______ mL。
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是_______ 。
A.容量瓶使用时未干燥 B.没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线 D.定容后液面低于刻度线,再加蒸馏水至刻度线
(3)为研究“84”消毒液的性质与使用条件,进行下列实验:
向三支试管中分别加入2 mL“84”消毒液和5滴紫色石蕊。继续进行如下实验:
①实验1中NaClO溶液与空气中二氧化碳反应的离子方程式为_______ 。(已知酸性: )
)
②实验3中生成气体的离子方程式为_______ 。
③综合以上实验为提高单位时间内“84”消毒液的漂白效果,你的建议是_______ 。
(1)常温,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为
(2)已知某“84”消毒液瓶体部分标签如图所示,请回答下列问题。
| “84”消毒液 有效成分:NaClO 规格:1000 mL 质量分数:25% 密度:1.192g/cm3 |
②“84”消毒液使用时需要稀释,某小组用上述“84”消毒液配制500 mL 0.2mol/L的稀溶液,需要用量筒量取该“84”消毒液体积为
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是
A.容量瓶使用时未干燥 B.没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线 D.定容后液面低于刻度线,再加蒸馏水至刻度线
(3)为研究“84”消毒液的性质与使用条件,进行下列实验:
向三支试管中分别加入2 mL“84”消毒液和5滴紫色石蕊。继续进行如下实验:
| 实验 | 操作 | 现象 |
| 实验1 | 加入2 mL蒸馏水 | 短时间内未褪色,一段时间后蓝色褪去 |
| 实验2 | 加入2 mL 0.0002 mol/L的H2SO4溶液 | 蓝色迅速褪去,无气体产生 |
| 实验3 | 加入2 mL 2 mol/L的H2SO4溶液 | 蓝色迅速褪去,并产生大量刺激性的气体 |
 )
)②实验3中生成气体的离子方程式为
③综合以上实验为提高单位时间内“84”消毒液的漂白效果,你的建议是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)2.4gRSO4中含0.02molR2+,则RSO4的摩尔质量是____ ;R的相对原子质量约是___ 。
(2)除去下列物质中所混有的少量杂质,指明应加入的试剂,写出有关的离子方程式。
NaHCO3溶液(Na2CO3):试剂_________ ,离子方程式:___________ 。
(3)实验室需要0.1mol/L的硫酸980mL,欲用密度为1.84g/cm3、溶质的质量分数为98%的浓硫酸进行配制,则需用量筒量取______ mL进行配制。假如其他操作均准确无误,若使用量筒量取时俯视读数,最终所配溶液的浓度________ (选填“偏高”、“偏低”或“无影响”);若溶解时未冷却,直接转移到容量瓶中至刻度线,最终所配溶液的浓度_________ (选填“偏高”、“偏低”或“无影响”)。
(4)实验室在制备 Fe(OH)2 时必须隔绝空气,否则发生的现象是__ 。反应化学方程式为___ 。
(2)除去下列物质中所混有的少量杂质,指明应加入的试剂,写出有关的离子方程式。
NaHCO3溶液(Na2CO3):试剂
(3)实验室需要0.1mol/L的硫酸980mL,欲用密度为1.84g/cm3、溶质的质量分数为98%的浓硫酸进行配制,则需用量筒量取
(4)实验室在制备 Fe(OH)2 时必须隔绝空气,否则发生的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】实验室用 固体配制
固体配制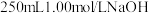 溶液,填空回答下列问题:
溶液,填空回答下列问题:
(1)配制该溶液时使用的仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还必须用到的玻璃仪器有___________ 、___________ 。
(2)配制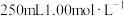 的
的 溶液的步骤如下,完成下列填空:
溶液的步骤如下,完成下列填空:
①计算:所需 固体的质量为
固体的质量为___________ ;
②称量
③溶解:将称量好的 固体放入烧杯中,然后用适量蒸馏水溶解,该步操作用到的另一仪器的作用
固体放入烧杯中,然后用适量蒸馏水溶解,该步操作用到的另一仪器的作用___________ 。
(3)其余步骤正确的操作顺序是(每个字母限用一次)___________ 。
A.用 水洗涤烧杯和玻璃棒
水洗涤烧杯和玻璃棒 次,洗涤液均注入容量瓶,振荡
次,洗涤液均注入容量瓶,振荡
B.将已冷却的 溶液沿玻璃棒注入容量瓶中
溶液沿玻璃棒注入容量瓶中
C.将容量瓶盖紧,颠倒摇匀
D.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
E.继续往容量瓶内小心加水,直到液面接近刻度 处
处
(4)实验中有关做法正确的是___________ (填字母)
A.用托盘天平称量时应左物右码
B.称量 时,将
时,将 固体放在滤纸上
固体放在滤纸上
C.使用容量瓶之前应先检验是否漏水
(5)若实验中出现下列情况对所配溶液浓度有什么影响?(填“偏高、偏低或无影响”)
①未洗涤烧杯和玻璃棒___________ ;
②定容时俯视刻度线___________ ;
③容量瓶中有少量蒸馏水___________ ;
(6)若定容时液面高于刻度线应采取的措施是___________ 。
 固体配制
固体配制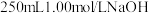 溶液,填空回答下列问题:
溶液,填空回答下列问题:(1)配制该溶液时使用的仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还必须用到的玻璃仪器有
(2)配制
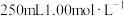 的
的 溶液的步骤如下,完成下列填空:
溶液的步骤如下,完成下列填空:①计算:所需
 固体的质量为
固体的质量为②称量
③溶解:将称量好的
 固体放入烧杯中,然后用适量蒸馏水溶解,该步操作用到的另一仪器的作用
固体放入烧杯中,然后用适量蒸馏水溶解,该步操作用到的另一仪器的作用(3)其余步骤正确的操作顺序是(每个字母限用一次)
A.用
 水洗涤烧杯和玻璃棒
水洗涤烧杯和玻璃棒 次,洗涤液均注入容量瓶,振荡
次,洗涤液均注入容量瓶,振荡B.将已冷却的
 溶液沿玻璃棒注入容量瓶中
溶液沿玻璃棒注入容量瓶中C.将容量瓶盖紧,颠倒摇匀
D.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
E.继续往容量瓶内小心加水,直到液面接近刻度
 处
处(4)实验中有关做法正确的是
A.用托盘天平称量时应左物右码
B.称量
 时,将
时,将 固体放在滤纸上
固体放在滤纸上C.使用容量瓶之前应先检验是否漏水
(5)若实验中出现下列情况对所配溶液浓度有什么影响?(填“偏高、偏低或无影响”)
①未洗涤烧杯和玻璃棒
②定容时俯视刻度线
③容量瓶中有少量蒸馏水
(6)若定容时液面高于刻度线应采取的措施是
您最近一年使用:0次
填空题
|
适中
(0.65)
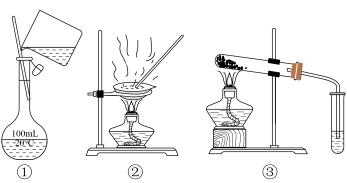
【推荐1】选择完成下列实验的装置。

(1)除去水中的泥沙用_______ (填序号,下同)。
(2)自来水制备蒸馏水用_______ 。
(3)配制100 mL 1.00 mol·L-1 NaCl溶液用_______ 。
(4)请写出①中仪器名称_______ 、_______ 、_______

(1)除去水中的泥沙用
(2)自来水制备蒸馏水用
(3)配制100 mL 1.00 mol·L-1 NaCl溶液用
(4)请写出①中仪器名称
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】下表为“鲜花保鲜剂”的配比表。
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是_______。
(2)配制240 mL的上述“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、电子天平、 _______ 、_______ 。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是_______。
(4)“鲜花保鲜剂”中K+(蔗糖和阿司匹林中不含K+)的物质的量浓度为_______ mol/L。
| 成分 | 质量(g) | 摩尔质量(g/mol) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿可匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是_______。
| A.蔗糖 | B.硫酸钾 | C.高锰酸钾 | D.硝酸银 |
(3)在溶液配制过程中,下列操作对配制结果没有影响的是_______。
| A.定容时俯视容量瓶刻度线 |
| B.容量瓶在使用前未干燥,里面有少量蒸馏水 |
| C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净 |
| D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理 |
您最近一年使用:0次

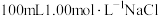 溶液,用
溶液,用

