化学反应的方向:对于可逆反应而言,有正向进行和逆向进行两个方向。一般地,判断反应方向有“焓判据”和“熵判据”两种判断方法。在此之前我们要先了解“熵”的概念。熵( )的定义式为
)的定义式为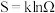 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):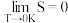
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能( ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: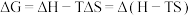
因此有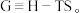 在压强与温度恒定时,若
在压强与温度恒定时,若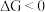 则正反应自发,若
则正反应自发,若 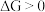 则逆反应自发,若
则逆反应自发,若 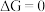 反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于
反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于
 )的定义式为
)的定义式为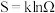 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):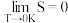
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能(
 ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: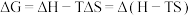
因此有
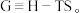 在压强与温度恒定时,若
在压强与温度恒定时,若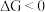 则正反应自发,若
则正反应自发,若 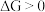 则逆反应自发,若
则逆反应自发,若 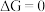 反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于
反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于| A.其反应熵变很小 |
| B.其反应需要的温度较高 |
| C.反应活化能较低 |
D.反应的体积功大(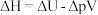 ,其中 ,其中 为其体积功) 为其体积功) |
2022高二上·安徽阜阳·竞赛 查看更多[1]
(已下线)安徽省界首第一中学2022-2023学年高二上学期趣味竞赛化学试题
更新时间:2022-10-26 15:58:28
|




