对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)镀铜可防止铁制品腐蚀,电镀时用铜作阳极,阳极电极方程式是:_______ 。在此过程中,两个电极上质量的变化值:阴极_______ 阳极(填“>”“<”或“=”)。
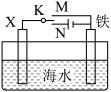
(2)利用如图所示的装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于_______ (填“M”或“N”)处。若X为锌,开关K置于M处,该电化学防护法称为_______ 。
(1)镀铜可防止铁制品腐蚀,电镀时用铜作阳极,阳极电极方程式是:
(2)利用如图所示的装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于

更新时间:2022-12-25 23:12:41
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_________ (填字母)。

a.金块 b.锌板 c.铜板 d.钠块
(2)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是_______ 。
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的总反应式相同
(3)如下图,装置I为CO燃料电池(电解质溶液为KOH涛液),通过装置II实现铁棒上镀铜。
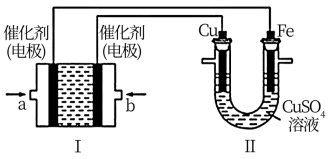
①b处应通入_______ (填“CO”或“O2”),a处电极上发生的电极反应式是_________ 。
②电镀结束后,装置I中溶液的pH______ (填写“变大”“变小”或“不变”);装置II中Cu2+的物质的量浓度________ (填写“变大”“变小”或“不变")。
③在此过程中若完全反应,装置II中阴极质量变化12.8 g,则装置I中理论上消耗CO______ L(标准状况下)。
(4)用惰性电极电解1000mL浓度均为1mol/L的CuSO4、HCl、AlCl3组成的混合溶液,一段时间后,阴、阳极收集到的气体体积相等,则阴、阳极收集到气体的总体积为______ L (假设产生的气体均在标况下测定,且所有气体均不考虑溶于水)。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择

a.金块 b.锌板 c.铜板 d.钠块
(2)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的总反应式相同
(3)如下图,装置I为CO燃料电池(电解质溶液为KOH涛液),通过装置II实现铁棒上镀铜。

①b处应通入
②电镀结束后,装置I中溶液的pH
③在此过程中若完全反应,装置II中阴极质量变化12.8 g,则装置I中理论上消耗CO
(4)用惰性电极电解1000mL浓度均为1mol/L的CuSO4、HCl、AlCl3组成的混合溶液,一段时间后,阴、阳极收集到的气体体积相等,则阴、阳极收集到气体的总体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】请按要求填写下列空白:
(1)氯碱工业的总反应的离子方程式:_________ 。
(2)甲烷燃料电池熔融碳酸盐环境负极电极反应式:_________ 。
(3)铅蓄电池充电时阳极的电极反应式:_________ 。
(4)钢铁发生吸氧腐蚀的电化学总反应:_________ 。
(5)工业上冶炼铝的离子方程式:________ 。
(1)氯碱工业的总反应的离子方程式:
(2)甲烷燃料电池熔融碳酸盐环境负极电极反应式:
(3)铅蓄电池充电时阳极的电极反应式:
(4)钢铁发生吸氧腐蚀的电化学总反应:
(5)工业上冶炼铝的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】铝作为一种应用广泛的金属,在电化学领域也发挥着举足轻重的作用。回答下列问题:
(1)某同学根据氧化还原反应:2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s),设计如图所示的原电池。
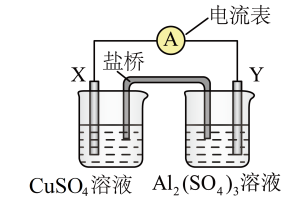
①两个电极一个是铜,一个是铝,电极X的化学式为_______ 。
②盐桥中的阴离子向_______ (填化学式)溶液中移动。
(2)新型电池中的铝电池类型较多。Li-Al/FeS是一种二次电池,可用于车载电源,其电池总反应为2Li+FeS=Li2S+Fe。放电时的正极反应式为_______ 。
(3)钢铁发生电化学腐蚀可分为析氢腐蚀和吸氧腐蚀,可以采用电化学手段进行防腐。
①写出钢铁在酸性较强的环境中发生电化学腐蚀的正极反应式:_______ 。
②为了减缓水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案:

其中连接在铁闸门上的固体材料R可以采用_______ (填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
(1)某同学根据氧化还原反应:2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s),设计如图所示的原电池。

①两个电极一个是铜,一个是铝,电极X的化学式为
②盐桥中的阴离子向
(2)新型电池中的铝电池类型较多。Li-Al/FeS是一种二次电池,可用于车载电源,其电池总反应为2Li+FeS=Li2S+Fe。放电时的正极反应式为
(3)钢铁发生电化学腐蚀可分为析氢腐蚀和吸氧腐蚀,可以采用电化学手段进行防腐。
①写出钢铁在酸性较强的环境中发生电化学腐蚀的正极反应式:
②为了减缓水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案:

其中连接在铁闸门上的固体材料R可以采用
A.铜 B.钠 C.锌 D.石墨
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】Ⅰ.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:_______________ ;
下列哪个装置示意图可防止铁棒被腐蚀___________________ 。

Ⅱ.某小组为研究电化学原理,设计如下图装置。请回答下列问题:

(1)a和b不连接时,铁片上发生反应的离子方程式为________________ ,
此时能量转化形式主要是化学能转化为__________ 能。
(2)a和b用导线连接时,外电路中的电子是从______ 电极流出(填“Fe”或“Cu”),______ (填Cu2+ 或SO42-)离子朝负极移动,Cu极所发生反应的电极反应式为______________ 。
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的________ (填“正极”或“负极”)连接;此时铜片上发生的电极反应式为________________________ 。
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:
下列哪个装置示意图可防止铁棒被腐蚀

Ⅱ.某小组为研究电化学原理,设计如下图装置。请回答下列问题:

(1)a和b不连接时,铁片上发生反应的离子方程式为
此时能量转化形式主要是化学能转化为
(2)a和b用导线连接时,外电路中的电子是从
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】CuSO4溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究。
(1)下图是根据反应Zn+CuSO4===Cu+ZnSO4设计成的锌铜原电池。
①该原电池的正极为_____________ ,其外电路中的电子是从_____________ 极(填“Zn”或“Cu”)流出。
②电解质溶液乙是_____________ (填“ZnSO4”或“CuSO4”)溶液,Zn极的电极反应式是___________ 。
③如果盐桥中的成分是K2SO4溶液,则盐桥中向左侧烧杯中移动的离子主要是_____________ 。
(2)下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。

①该同学想在Ⅱ中实现铁上镀铜,电解前CuSO4溶液的浓度为1mol/L,当线路中有0.1 mol电子通过时,则此时电解液CuSO4溶液的浓度为_____________ ,阴极增重_____________ g。
②b处通入的是_____________ (填“CH4”或“O2”),a处电极上发生的电极反应式是_________ 。
(1)下图是根据反应Zn+CuSO4===Cu+ZnSO4设计成的锌铜原电池。

①该原电池的正极为
②电解质溶液乙是
③如果盐桥中的成分是K2SO4溶液,则盐桥中向左侧烧杯中移动的离子主要是
(2)下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。

①该同学想在Ⅱ中实现铁上镀铜,电解前CuSO4溶液的浓度为1mol/L,当线路中有0.1 mol电子通过时,则此时电解液CuSO4溶液的浓度为
②b处通入的是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】装置如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。氢氧化铁胶体的胶粒带正电荷。请回答:

(1)甲中溶液的pH________ (填“变大”“变小”或“不变”)。
(2)乙溶液中总反应的离子方程式是________ 。一段时间后丁中X极附近的颜色逐渐________ (填“变深”或“变浅”)。
(3)现用丙装置给铜件镀银,则H应该是________ (填“铜”或“银”)。
(4)当外电路中通过0.04mol电子时,甲装置内共收集到0.448L气体(标准状况),若甲装置内的液体体积为200mL(电解前后溶液体积不变),则电解前CuSO4溶液的物质的量浓度是________ 。

(1)甲中溶液的pH
(2)乙溶液中总反应的离子方程式是
(3)现用丙装置给铜件镀银,则H应该是
(4)当外电路中通过0.04mol电子时,甲装置内共收集到0.448L气体(标准状况),若甲装置内的液体体积为200mL(电解前后溶液体积不变),则电解前CuSO4溶液的物质的量浓度是
您最近一年使用:0次



