锰酸锂离子电池在混合动力车等大型蓄电池应用领域占据主导地位。电池反应式为:Li1-xMnO4+xLi LiMnO4,下列有关说法不正确的是
LiMnO4,下列有关说法不正确的是
 LiMnO4,下列有关说法不正确的是
LiMnO4,下列有关说法不正确的是| A.放电时电池的正极反应式为:Li1-xMnO4+xLi++xe-=LiMnO4 |
| B.放电过程中,内电路电流方向是从负极到正极 |
| C.该电池也能在KOH溶液的环境中正常工作 |
| D.放电时Li+向电池正极方向定向迁移 |
更新时间:2023-04-27 18:03:58
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】某商用锂离子电池以石墨为负极材料,以LiCoO2为正极材料,电解质为LiPF6与乙烯碳酸酯。电池充电时,锂离子从正极材料中出来而进入负极,放电时则反过来。那么,下列说法中不正确的是
| A.充电时发生的正极反应为LiCoO2 →Li1-xCoO2 +xLi+ + xe- |
| B.负极反应为xLi++xe- +6C→LixC6 |
| C.正极材料Li1-xCoO2中的Co充电时被氧化,从Co3+变为Co4+,放电时被还原,从Co4+变为Co3+ |
| D.LiAlO2 和LiMn2O4等也可做正极材料 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
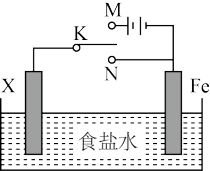
【推荐2】带有充满电解质KCl的饱和溶液盐桥的锌铜原电池工作时,下列叙述不正确的是
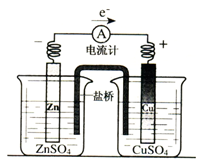
| A.用还原性较强的物质做为负极,负极向外提供电子:用氧化性较强的物质作为正极,正极从外电路得到电子 |
| B.盐桥中的K+会移向ZnSO4溶液,Cl-移向CuSO4溶液,使两个半电池保持中性 |
| C.盐桥的引入,解决了Zn直接与CuSO4溶液反应降低原电池工作效率的问题 |
| D.放电时,负极上的电子通过导线流向正极,再通过溶液中离子形成的内电路构成环路 |
您最近半年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】一种可连续使用的锂电池结构如图所示,下列有关该电池放电时的说法正确的是


| A.电子由Li电极经Li+透过膜进入Fe2+、Fe3+的水溶液移向Ti电极 |
| B.Ti电极上发生的电极反应为:Fe3+ + e- = Fe2+ |
| C.Li+透过膜除允许Li+通过外,还允许H2O分子通过 |
| D.贮罐中发生的离子反应为:S2O82- + 2Fe3+ = 2Fe2+ + 2SO42- |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】氨硼烷(NH3·BH3)电池可在常温下工作,装置如下图。该电池工作时的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。 下列说法正确的是
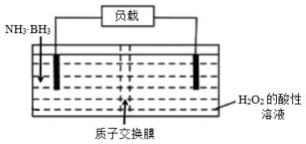

| A.电流从左侧电极经过负载后流向右侧电极 |
| B.BO2-通过质子交换膜向正极移动 |
| C.负极附近溶液pH增大 |
| D.正极的反应式为 3H2O2+6H++6e-=6H2O |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
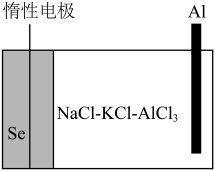
【推荐1】近期,科学家研发出了一种新型铝电池。该电池电极分别为铝和硒,熔盐电解质由氯化钠(NaCl)、氯化钾(KCl)和氯化铝( )组成(如图所示)。其中,电池放电过程中会形成
)组成(如图所示)。其中,电池放电过程中会形成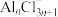 ,放电总反应的离子方程式为
,放电总反应的离子方程式为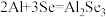 .下列说法错误的是
.下列说法错误的是
 )组成(如图所示)。其中,电池放电过程中会形成
)组成(如图所示)。其中,电池放电过程中会形成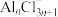 ,放电总反应的离子方程式为
,放电总反应的离子方程式为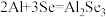 .下列说法错误的是
.下列说法错误的是
| A.充电时,电极Al为阴极 |
| B.放电时,Al电极附近的阴离子浓度降低 |
| C.放电时,电路中每转移1 mol电子,理论上正极质量增加9 g |
D.充电时,阳极的电极反应式为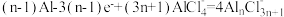 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】特斯拉全电动汽车使用的是钴酸锂电池,其工作原理如下图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式LixC6+Li1-xCoO2 C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是
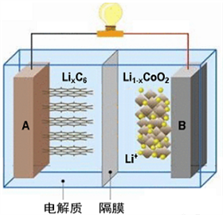
 C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是
| A.放电时电子从A极通过导线流向B极 | B.放电时A是负极 |
| C.放电时Li+从右向左定向迁移 | D.钴酸锂电池为二次电池 |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐1】某低成本储能电池原理如下图所示。下列说法正确的是


| A.放电时负极质量减小 |
| B.储能过程中电能转变为化学能 |
C.放电时右侧 通过质子交换膜移向左侧 通过质子交换膜移向左侧 |
D.充电总反应: |
您最近半年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
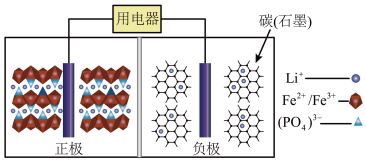
原理如下:(1-x)LiFePO4+xFePO4+LixCn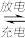 LiFePO4+nC。
LiFePO4+nC。
下列说法不正确 的是

原理如下:(1-x)LiFePO4+xFePO4+LixCn
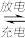 LiFePO4+nC。
LiFePO4+nC。下列说法
| A.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4 |
| B.放电时,电子由负极经导线、用电器、导线到正极 |
| C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn |
| D.充电时,当导线中传递l mol电子,理论上将有1 mol Li+向左移动 |
您最近半年使用:0次

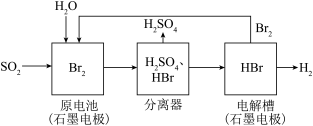
 +4H+
+4H+