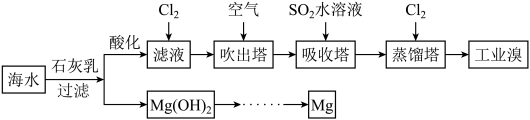
Ⅰ.浩瀚的海洋里蕴藏着丰富的化学资源。利用海水可以提取溴和镁,提取过程如下:___________ 。
(2)提取溴的过程中,滤液中通入Cl2生成Br2的离子方程式___________ 。经过2次Br→Br2转化的目的是___________ 。
(3)吸收塔中发生反应的离子方程式是___________ 。
(4)Mg(OH)2的电子式为___________ ,通过将Mg(OH)2转化为无水MgCl2以制备单质Mg,无水MgCl2制取单质Mg的化学方程式是___________ 。
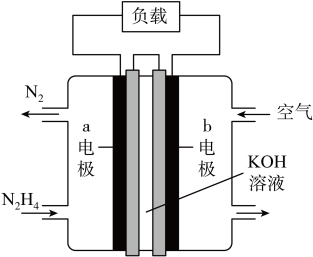
Ⅱ.为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,回答下列问题:___________ ,负极发生的反应式为___________ 。
(6)电池工作时, 移向
移向___________ 电极(填“a”或“b”)。
(7)当电池放电转移10mol电子时,至少消耗燃料肼___________ g。
(2)提取溴的过程中,滤液中通入Cl2生成Br2的离子方程式
(3)吸收塔中发生反应的离子方程式是
(4)Mg(OH)2的电子式为
Ⅱ.为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,回答下列问题:
(6)电池工作时,
 移向
移向(7)当电池放电转移10mol电子时,至少消耗燃料肼
22-23高一下·辽宁·期末 查看更多[2]
更新时间:2023-07-28 12:56:22
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:

(1)若该燃料电池为氢氧燃料电池。
①a极通入的物质为____________ ,电解质溶液中的OH-移向________ 极(填“负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式:____________ 。
(2)若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-= +3H2O
+3H2O
①下列有关说法正确的是________ (填字母代号)。
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH-– 8e-= +7H2O
+7H2O
C.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
②当消耗甲烷11.2L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为_______ mol.

(1)若该燃料电池为氢氧燃料电池。
①a极通入的物质为
②写出此氢氧燃料电池工作时,负极的电极反应式:
(2)若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-=
 +3H2O
+3H2O①下列有关说法正确的是
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH-– 8e-=
 +7H2O
+7H2OC.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
②当消耗甲烷11.2L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】如图所示是原电池的装置图。请回答:

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___ ;反应进行一段时间后溶液酸性将__ (填“增强”“减弱”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___ ,B(负极)极材料为__ ,溶液C为___ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
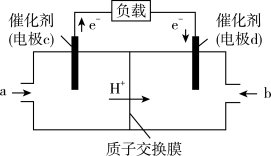
电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是__ (填“正极”或“负极”),c电极的反应方程式为__ 。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为__ L。

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】两种电化学装置如图所示。
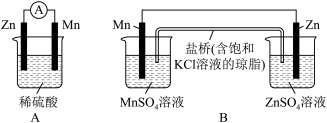
已知金属活泼性: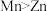 。
。
回答下列问题:
(1)从能量的角度分析,装置B将_______ 能转化为_______ 能。
(2)①装置A工作时,Zn电极为_______ (填“正极”或“负极”),发生的电极反应为_______ 。
②利用装置A进行实验,发现锌片、锰片质量均减轻,说明装置中除了发生电化学反应,还发生非电化学反应,该反应的离子方程式为_______ 。实验结束时测得电解质溶液增加32.8g,电流表中有1mol电子发生转移,则锌溶解了_______ g。
(3)①装置B工作时盐桥中的K+流向_______ (填“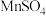 ”或“
”或“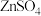 ”)溶液。
”)溶液。
②若装置B中负极金属的消耗速率为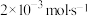 ,则盐桥中K+的迁移速率为
,则盐桥中K+的迁移速率为____ 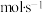 。
。

已知金属活泼性:
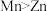 。
。回答下列问题:
(1)从能量的角度分析,装置B将
(2)①装置A工作时,Zn电极为
②利用装置A进行实验,发现锌片、锰片质量均减轻,说明装置中除了发生电化学反应,还发生非电化学反应,该反应的离子方程式为
(3)①装置B工作时盐桥中的K+流向
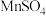 ”或“
”或“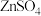 ”)溶液。
”)溶液。②若装置B中负极金属的消耗速率为
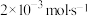 ,则盐桥中K+的迁移速率为
,则盐桥中K+的迁移速率为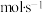 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】海水中含有大量的卤族元素,具有十分巨大的开发利用潜力。
I.氯气是非常重要的化工产品
(1)用浓盐酸和二氧化锰制氯气是实验室常用的方法,写出该反应的化学方程式:_____ 。
(2)也可用浓盐酸和高锰酸钾制氯气,反应方程式如下:2KMnO4+16HCl(浓)=KCl+2MnCl2+5Cl2↑+8H2O,实验室用该方法制氯气时,可选用的发生装置是___________ (写编号)。
(3)为证明氯气与水反应产物具有漂白性,将Cl2缓缓通过下列装置:
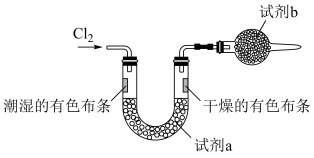
试剂a应选择___________ ;试剂b的作用是___________ ;___________ 。
(4)通常使用84消毒液时需要把消毒对象在其中浸泡一段时间,以提高消毒效果。请结合反应方程式分析原因___________
II.地球上99%的溴元素以Br-形式存在于海水中。海水中Br-含量约为65mg/L,而苦卤(海水晒盐后得到的母液)中Br-含量高很多,苦卤常作海水提溴的主要原料。目前最成熟的“空气吹出法”海水提溴工艺流程如图(已知:溴的沸点为59℃):
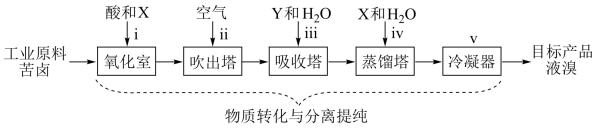
(5)为实现Br-转化为Br2的目的,所加试剂X应必有的化学性质是___________ 。
(6)利用“空气吹出法”将“氧化室”产生的低浓度Br2分离出来的方法利用了溴的___________ 这一物理性质。
(7)将低浓度Br2富集为高浓度Br2历经步骤iii反应的离子方程式为:___________ 。
I.氯气是非常重要的化工产品
(1)用浓盐酸和二氧化锰制氯气是实验室常用的方法,写出该反应的化学方程式:
(2)也可用浓盐酸和高锰酸钾制氯气,反应方程式如下:2KMnO4+16HCl(浓)=KCl+2MnCl2+5Cl2↑+8H2O,实验室用该方法制氯气时,可选用的发生装置是
| 编号 | A | B | C |
| 发生装置 | 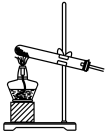 |  | 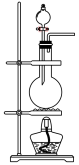 |

试剂a应选择
(4)通常使用84消毒液时需要把消毒对象在其中浸泡一段时间,以提高消毒效果。请结合反应方程式分析原因
II.地球上99%的溴元素以Br-形式存在于海水中。海水中Br-含量约为65mg/L,而苦卤(海水晒盐后得到的母液)中Br-含量高很多,苦卤常作海水提溴的主要原料。目前最成熟的“空气吹出法”海水提溴工艺流程如图(已知:溴的沸点为59℃):

(5)为实现Br-转化为Br2的目的,所加试剂X应必有的化学性质是
(6)利用“空气吹出法”将“氧化室”产生的低浓度Br2分离出来的方法利用了溴的
(7)将低浓度Br2富集为高浓度Br2历经步骤iii反应的离子方程式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】海水约占地球总储水量的97%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量氯化钠,氯化钠的电子式为________________ ,氯化钠中的非金属元素在元素周期表中的位置为第________ 周期第________ 族。
(2)目前,国际上广泛应用的海水淡化的主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得到高纯度淡水,由此可判断蒸馏的过程中发生的是________ (填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应方程式为________________________ ,检验阳极产物的方法是________________________ 。
(4)工业上从海水中提取溴,第一步是将氯气通入富含溴离子的海水中,将溴置换出来;第二步用空气把溴吹出,用SO2的水溶液吸收,使溴转化为氢溴酸;第三步用氯气氧化氢溴酸即得单质溴。写出上述过程中第一、二步发生反应的离子方程式:①______________________ ;②____________________________ 。
(1)海水中含有大量氯化钠,氯化钠的电子式为
(2)目前,国际上广泛应用的海水淡化的主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得到高纯度淡水,由此可判断蒸馏的过程中发生的是
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应方程式为
(4)工业上从海水中提取溴,第一步是将氯气通入富含溴离子的海水中,将溴置换出来;第二步用空气把溴吹出,用SO2的水溶液吸收,使溴转化为氢溴酸;第三步用氯气氧化氢溴酸即得单质溴。写出上述过程中第一、二步发生反应的离子方程式:①
您最近一年使用:0次
【推荐3】回答下列问题:
(1)观察 A、B、C、D、E 五种微粒(原子或离子)的结构示意图回答有关问题:
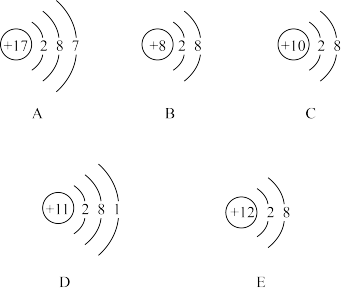
①属于离子的是_______ (填字母);
②性质最稳定的原子是_____ (填字母)。 最容易失去电子的原子是_____ (填字母),最容易得到电子的原子是_____ (填字母)
③用电子式表示 A、D 形成离子化合物的过程:_____ 。
(2)地球上 99%的溴元素以 Br-的形式存在于海水中,所以人们也把溴称为“海洋元素”。工业上提取溴的操作可分为浓缩、氧化、提纯等步骤,请回答:
①如何检验苦卤中是否含有Br-_____ ;
②Cl2氧化 Br-应在_______ 性条件下进行,请写出对应的离子方程式_______ ;目的是为了避免_______ ;
③Br2可用热空气吹出,其原因是_______ ;
④请列举溴的两种用途:_______ 。
(1)观察 A、B、C、D、E 五种微粒(原子或离子)的结构示意图回答有关问题:

①属于离子的是
②性质最稳定的原子是
③用电子式表示 A、D 形成离子化合物的过程:
(2)地球上 99%的溴元素以 Br-的形式存在于海水中,所以人们也把溴称为“海洋元素”。工业上提取溴的操作可分为浓缩、氧化、提纯等步骤,请回答:
①如何检验苦卤中是否含有Br-
②Cl2氧化 Br-应在
③Br2可用热空气吹出,其原因是
④请列举溴的两种用途:
您最近一年使用:0次



