燃料的热值是指单位质量某种燃料完全燃烧放出的热量,其常用单位为kJ·kg-1。已知下列物质的摩尔燃烧焓(25 ℃、101 kPa):
据上表数据回答下列问题:
(1)试写出表示辛烷摩尔燃烧焓的热化学方程式:___________ 。
(2)CH4的热值约为___________ (保留3位有效数字)。
(3)上表所列燃料的热值最大的是___________ (填化学式)。
| 燃料 | H2 | CO | CH4 | C8H18(辛烷) |
| 摩尔燃烧焓/(kJ·mol-1) | -285.8 | -283.0 | -890.3 | -5 518 |
(1)试写出表示辛烷摩尔燃烧焓的热化学方程式:
(2)CH4的热值约为
(3)上表所列燃料的热值最大的是
2023高三上·全国·专题练习 查看更多[1]
(已下线)第1讲 化学能与热能
更新时间:2023-10-19 01:31:58
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】题图中:E1=134kJ·mol-1,E2=368kJ·mol-1,根据要求回答问题:

(1)如图是1molNO2(g)和1 molCO(g)反应生成CO2和NO过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:_____ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为_______ 。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566.0kJ/mol
③H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
请写出1 mol甲醇不完全燃烧生成1 mol 一氧化碳和液态水的热化学方程式:_______ 。

(1)如图是1molNO2(g)和1 molCO(g)反应生成CO2和NO过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+
 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1又知③H2O(g)===H2O(l) ΔH=-44kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566.0kJ/mol
③H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
请写出1 mol甲醇不完全燃烧生成1 mol 一氧化碳和液态水的热化学方程式:
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图。请写出N2和H2反应的热化学方程式___ 。

已如化学键键能是形成或拆开1 mol化学键放出或吸收的能量,单位kJ/mol。若已知下表数据,试根据表中及图中数据计算N-H的键能____ kJ/mol(用含a、b的式子表示)
(2)用NH3催化还原NOx还可以消除氮氧化物的污染。
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H1=-m kJ/mol①
N2(g)+O2(g)=2NO(g)△H2=-n kJ/mol②
用NH3还原NO至N2,则反应过程中的反应热△H3=___ kJ/mol(用含m、n的式子表示)。
(3)肼(N2H4)是一种可燃性液体,可作火箭燃料。在常温下,1 g肼在氧气中完全燃烧生成氮气,放出Q kJ的热量,写出N2H4燃烧热的热化学方程式____ 。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图。请写出N2和H2反应的热化学方程式

已如化学键键能是形成或拆开1 mol化学键放出或吸收的能量,单位kJ/mol。若已知下表数据,试根据表中及图中数据计算N-H的键能
| 化学键 | H-H | N N N |
| 键能/kJ/mol | a | b |
(2)用NH3催化还原NOx还可以消除氮氧化物的污染。
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H1=-m kJ/mol①
N2(g)+O2(g)=2NO(g)△H2=-n kJ/mol②
用NH3还原NO至N2,则反应过程中的反应热△H3=
(3)肼(N2H4)是一种可燃性液体,可作火箭燃料。在常温下,1 g肼在氧气中完全燃烧生成氮气,放出Q kJ的热量,写出N2H4燃烧热的热化学方程式
您最近一年使用:0次
【推荐3】化学反应原理对化学反应的研究具有指导意义。
(1)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
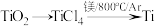
已知:①C(s)+O2(g)=CO2(g);ΔH=-3935kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);ΔH=+141kJ·mol-1则
(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______ 。
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2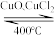 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.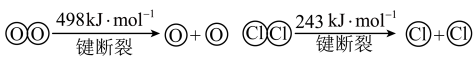
(2)写出该条件下,反应A的热化学方程式为_______ 。
(3)断开1molH-O键与断开1molH-Cl键所需能量相差约为_______ kJ。
(3)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
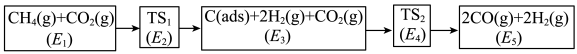
说明:C(ads)为吸附性活性炭,E表示方框中物质总能量(单位:kJ/mol),TS表示过渡态。
(4)制备合成气总反应的 可表示为
可表示为_______ kJ·mol-1。
(5)若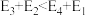 ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为_______ 。
(1)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
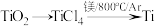
已知:①C(s)+O2(g)=CO2(g);ΔH=-3935kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);ΔH=+141kJ·mol-1则
(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2
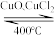 2Cl2+2H2O
2Cl2+2H2O已知:ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.
(2)写出该条件下,反应A的热化学方程式为
(3)断开1molH-O键与断开1molH-Cl键所需能量相差约为
(3)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
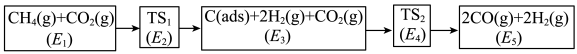
说明:C(ads)为吸附性活性炭,E表示方框中物质总能量(单位:kJ/mol),TS表示过渡态。
(4)制备合成气总反应的
 可表示为
可表示为(5)若
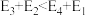 ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】完成下列问题
(1)标准状况下,6.72LC2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7kJ热量,请写出表示C2H2燃烧热的热化学方程式:___________ 。
(2)已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=—akJ·mol−1
H2(g)+ O2(g)=H2O(l) ΔH2=—bkJ·mol−1
O2(g)=H2O(l) ΔH2=—bkJ·mol−1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=—ckJ·mol−1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的ΔH为___________ kJ·mol-1(用含a、b、c的式子表示)。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示。
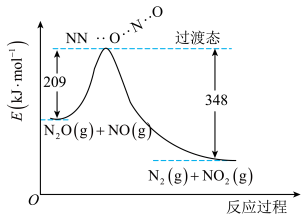
则反应过程中,每生成2molN2理论上放出的热量为___________ 。
(1)标准状况下,6.72LC2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7kJ热量,请写出表示C2H2燃烧热的热化学方程式:
(2)已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=—akJ·mol−1
H2(g)+
 O2(g)=H2O(l) ΔH2=—bkJ·mol−1
O2(g)=H2O(l) ΔH2=—bkJ·mol−1CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=—ckJ·mol−1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的ΔH为
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示。

则反应过程中,每生成2molN2理论上放出的热量为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是________________________
(2)如图是某温度下,N2与H2反应过程中能量变化的曲线图。

a、b两条曲线产生区别的原因很可能是________________ 。
(3)在101 kPa时,H2在1.00 mol O2中完全燃烧生成2.00 mol H2O(l)时放出571.6 kJ热量,则H2的热值为________
(4)已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH=489.0 kJ·mol-1
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
由Fe(s)和O2(g)反应生成Fe2O3(s)的热化学方程式为_______________________________ 。
(2)如图是某温度下,N2与H2反应过程中能量变化的曲线图。

a、b两条曲线产生区别的原因很可能是
(3)在101 kPa时,H2在1.00 mol O2中完全燃烧生成2.00 mol H2O(l)时放出571.6 kJ热量,则H2的热值为
(4)已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH=489.0 kJ·mol-1
CO(g)+
 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
由Fe(s)和O2(g)反应生成Fe2O3(s)的热化学方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1mol甲醇(CH3OH)燃烧生成CO2和液态水时放热725.76kJ。则表示甲醇燃烧热的热化学方程式为_______
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量_______ 。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量_______ 。
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_______ 。
(1)在25℃、101kPa下,1mol甲醇(CH3OH)燃烧生成CO2和液态水时放热725.76kJ。则表示甲醇燃烧热的热化学方程式为
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】已知,在25℃和101kPa下,部分化学键的键能数据如表所示。
(1)在25℃和101kPa下,工业合成氨,每生成 就会放出46kJ热量,在该条件下,能成向某容器中加入1mol N2(g)、3molH2(g)及合适的催化剂,充分反应后测得其放出的热量小于92kJ,原因可能是
就会放出46kJ热量,在该条件下,能成向某容器中加入1mol N2(g)、3molH2(g)及合适的催化剂,充分反应后测得其放出的热量小于92kJ,原因可能是___________ ,表中的a=___________ 。
(2)科学家发现一种新的气态分子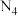 (
(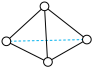 )。在25℃和101kPa下
)。在25℃和101kPa下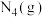 转化为
转化为 的热化学方程式为
的热化学方程式为___________ 。
| 化学键 | H-H | H-N |  | O-O | C-H | C=O | H-O | N-N |
| 键能/(kJ/mol) | 436 | 391 | a | 498 | 414 | 803 | 462 | 193 |
 就会放出46kJ热量,在该条件下,能成向某容器中加入1mol N2(g)、3molH2(g)及合适的催化剂,充分反应后测得其放出的热量小于92kJ,原因可能是
就会放出46kJ热量,在该条件下,能成向某容器中加入1mol N2(g)、3molH2(g)及合适的催化剂,充分反应后测得其放出的热量小于92kJ,原因可能是(2)科学家发现一种新的气态分子
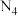 (
( )。在25℃和101kPa下
)。在25℃和101kPa下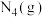 转化为
转化为 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】已知:H2(g)+ O2(g)
O2(g) H2O(l),反应过程中能量变化如图所示,则:
H2O(l),反应过程中能量变化如图所示,则:

①a、b、c分别代表什么意义?
a___________________________________ ;
b_____________________________ ;
c___________________________________ 。
②该反应是______ 反应(填“吸热”或“放热”),ΔH_______ 0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是______ 。(请写两条)
(3)已知:H2(g)+ O2(g)
O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
H2(l) H2(g) ΔH=+0.92 kJ·mol-1
H2(g) ΔH=+0.92 kJ·mol-1
O2(l) O2(g) ΔH=+6.84 kJ·mol-1
O2(g) ΔH=+6.84 kJ·mol-1
请写出1mol液氢和液氧生成液态水的热化学方程式:______________________________ 。
 O2(g)
O2(g) H2O(l),反应过程中能量变化如图所示,则:
H2O(l),反应过程中能量变化如图所示,则:
①a、b、c分别代表什么意义?
a
b
c
②该反应是
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是
(3)已知:H2(g)+
 O2(g)
O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1H2(l)
 H2(g) ΔH=+0.92 kJ·mol-1
H2(g) ΔH=+0.92 kJ·mol-1 O2(l)
 O2(g) ΔH=+6.84 kJ·mol-1
O2(g) ΔH=+6.84 kJ·mol-1请写出1mol液氢和液氧生成液态水的热化学方程式:
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: ___________ 。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
已知反应N2+3H2 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________ 。
(3)以CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,且c初始(CO)=1×10-4mol·L-1,反应体系起始总压强为0.1a MPa, 1150℃下,反应:CaSO4(s) + CO(g) CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=
CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________ MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2
 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:(3)以CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,且c初始(CO)=1×10-4mol·L-1,反应体系起始总压强为0.1a MPa, 1150℃下,反应:CaSO4(s) + CO(g)
 CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=
CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=
您最近一年使用:0次



