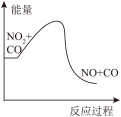
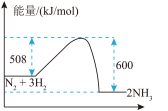
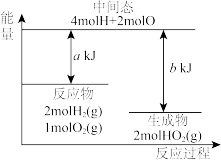
下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是
|
|
| 白磷比红磷更稳定 | 石墨转变为金刚石是放热反应 |
| A | B |
|
|
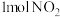 和 和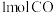 的键能总和小于 的键能总和小于 和 和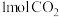 的键能总和 的键能总和 | 将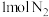 与 与 充入密闭容器中发生反应 充入密闭容器中发生反应 ,充分反应后放出92kJ的热量 ,充分反应后放出92kJ的热量 |
| C | D |
| A.A | B.B | C.C | D.D |
更新时间:2023-09-17 16:10:11
|
相似题推荐
单选题
|
容易
(0.94)
名校
解题方法
【推荐1】化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1 mol共价键(或其可逆过程)时释放(或吸收)的能量。已知H—H键的键能为436 kJ·mol-1、Cl—Cl键的键能为243 kJ·mol-1、H—Cl键的键能为x,若1 mol H2(g)与1 mol Cl2(g)反应生成2 mol HCl(g)放出183 kJ的热量,则x为( )
| A.496 kJ·mol-1 | B.431 kJ·mol-1 | C.862 kJ·mol-1 | D.248 kJ·mol-1 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
【推荐2】从如图所示的某气体反应的能量变化分析,以下判断错误的是( )


| A.这是一个放热反应 |
| B.该反应可能需要加热 |
| C.生成物中的总键能高于反应物中的总键能 |
| D.反应物比生成物更稳定 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐1】下列说法不正确的是
| A.生成物总能量高于反应物总能量的反应是吸热反应 |
| B.需要加热才能发生的反应一定是吸热反应 |
| C.化学反应一定会伴随能量的变化 |
D.由C(石墨,S)=C(金刚石,s)吸收的能量为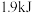 ,可知石墨比金刚石稳定 ,可知石墨比金刚石稳定 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】在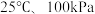 下,
下,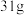 白磷完全转化为红磷,放出
白磷完全转化为红磷,放出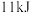 的热量,下列说法正确的是
的热量,下列说法正确的是
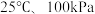 下,
下,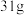 白磷完全转化为红磷,放出
白磷完全转化为红磷,放出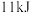 的热量,下列说法正确的是
的热量,下列说法正确的是| A.红磷转化为白磷属于放热反应 |
| B.二者更稳定的是白磷 |
C.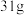 白磷与 白磷与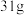 红磷的能量较高的是白磷 红磷的能量较高的是白磷 |
| D.等质量的红磷和白磷分别完全燃烧,放出热量较多的是红磷 |
您最近一年使用:0次
单选题
|
容易
(0.94)
【推荐1】某反应的能量变化如图所示,对于该图的理解,一定正确的是
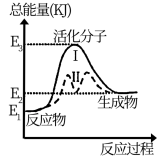

| A.过程Ⅰ比过程Ⅱ的反应速率快 | B. 为过程Ⅰ的活化能 为过程Ⅰ的活化能 |
| C.从曲线Ⅱ可知该反应为放热反应 | D.该反应的反应热 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
【推荐2】下列反应属于吸热反应的是 ( )
| A.酸碱中和反应 | B.葡萄糖在人体内氧化分解 |
| C.Ba(OH)2·8H2O与NH4Cl反应 | D.锌粒与稀H2SO4反应制取H2 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐1】某反应A(g)+B(g)=C(g)的能量变化如图所示,下列说法正确的是
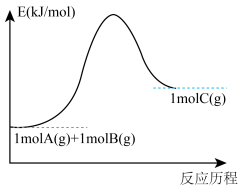

| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.生成物的总键能高于反应物的总键能 |
| D.该反应只有在加热条件下才能进行 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】肼(H2N-NH2)是一种高能燃料,共价键的键能与热化学方程式信息如表:
则2N(g)=N2(g)的ΔH为
| 共价键 | N-H | N-N | O=O | O-H |
| 键能/(kJ/mol) | 391 | 161 | 498 | 463 |
| 热化学方程式 | N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-570kJ·mol-1 | |||
| A.+1882kJ·mol-1 | B.-941kJ·mol-1 | C.-483kJ·mol-1 | D.-1882kJ·mol-1 |
您最近一年使用:0次

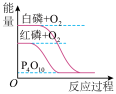
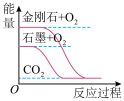
 ,则金刚石比石墨稳定
,则金刚石比石墨稳定 与
与 的反应
的反应 的反应
的反应

