请回答下列问题:
(1)现有下列物质,请用序号填空:①氧化钠固体 ②胆矾晶体 ③熔融氯化钠 ④稀盐酸 ⑤氨水 ⑥蔗糖 ⑦二氧化碳。上述状态下可导电的是_______ 。属于强电解质的是_______ 。
(2)向50ml沸水中加入5~6滴饱和FeCl3溶液,加热至产生红褐色液体,停止加热,利用_______ 来证明得到的分散系是氢氧化铁胶体。
(3)NaHSO4 固体溶于水的电离方程式为_______ ;
(4)写出硫酸铁和氢氧化钡溶液反应的离子方程式为_______ 。
(5)A、B、C、D为四种可溶性的盐,它们包含的阳离子和阴离子分别为Ba2+、Ag+、Na+、Cu2+和NO 、SO
、SO 、Cl-、CO
、Cl-、CO (离子在物质中不能重复出现)。
(离子在物质中不能重复出现)。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据实验事实可推断它们的化学式为:C_______ ,D_______ ;A溶液中阴离子的检验方法_______ 。
(1)现有下列物质,请用序号填空:①氧化钠固体 ②胆矾晶体 ③熔融氯化钠 ④稀盐酸 ⑤氨水 ⑥蔗糖 ⑦二氧化碳。上述状态下可导电的是
(2)向50ml沸水中加入5~6滴饱和FeCl3溶液,加热至产生红褐色液体,停止加热,利用
(3)NaHSO4 固体溶于水的电离方程式为
(4)写出硫酸铁和氢氧化钡溶液反应的离子方程式为
(5)A、B、C、D为四种可溶性的盐,它们包含的阳离子和阴离子分别为Ba2+、Ag+、Na+、Cu2+和NO
 、SO
、SO 、Cl-、CO
、Cl-、CO (离子在物质中不能重复出现)。
(离子在物质中不能重复出现)。①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据实验事实可推断它们的化学式为:C
更新时间:2023-12-18 10:09:32
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一、某中学的化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究。
I.甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,而今总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋。正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋。
②酿造醋国家标准为醋酸含量必须大于3.50g/100mL,而配制醋国家标准仅为1.50g~3.50g/100mL。
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L。
(1)请帮助甲同学计算从超市购买的食醋中醋酸含量为___________ g/100mL,属于___________ 醋(填“酿造”或“配制”,醋酸的化学式为CH3COOH)。
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式___________ 。
Ⅱ.如图是该学校化学实验室浓盐酸试剂标签上的部分内容。乙同学现用该浓盐酸配制100mL 1mol•L﹣1的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:

(1)配制稀盐酸时,还缺少的仪器有___________ 。
(2)经计算,配制100mL1mol•L﹣1的稀盐酸需要用量筒量取上述浓盐酸的体积为___________ mL。
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol•L﹣1,引起误差的原因可能是___________ 。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
Ⅲ.丙同学对课堂上学到的胶体的相关知识产生了浓厚兴趣。他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,在垂直于光束的方向上观察到鸡蛋清溶液中有一条光亮的通路,此现象称为___________ 。
I.甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,而今总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋。正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋。
②酿造醋国家标准为醋酸含量必须大于3.50g/100mL,而配制醋国家标准仅为1.50g~3.50g/100mL。
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L。
(1)请帮助甲同学计算从超市购买的食醋中醋酸含量为
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式
Ⅱ.如图是该学校化学实验室浓盐酸试剂标签上的部分内容。乙同学现用该浓盐酸配制100mL 1mol•L﹣1的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:

(1)配制稀盐酸时,还缺少的仪器有
(2)经计算,配制100mL1mol•L﹣1的稀盐酸需要用量筒量取上述浓盐酸的体积为
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol•L﹣1,引起误差的原因可能是
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
Ⅲ.丙同学对课堂上学到的胶体的相关知识产生了浓厚兴趣。他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,在垂直于光束的方向上观察到鸡蛋清溶液中有一条光亮的通路,此现象称为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】甲、乙、丙、丁分别是Ba(OH)2、AgNO3、FeCl3、Na2SO4中的一种物质。将甲、乙、丙、丁四种溶液两两相互反应,记录的反应现象信息如表:
已知:AgOH是一种白色难溶于水的固体,常温下极不稳定,易分解为褐色微溶于水的氧化银。
回答下列问题:
(1)甲的化学式为________ ,丙的化学式为________ 。
(2)乙在水溶液中的电离方程式为________ 。
(3)用离子方程式表示乙溶液与丙溶液反应的实质:________ 。
(4)将少量饱和丁溶液滴入沸水中,煮沸至液体呈________ 色时停止加热,所得分散系与甲溶液的本质区别是________ 。
(5)乙溶液与丁溶液恰好反应后过滤,检验滤液中主要阴离子的操作是________ 。
| 甲 | 乙 | 丙 | |
| 乙 | 开始有白色浑浊,振荡后有褐色物质出现 | 有白色沉淀生成,反应后溶液呈强碱性 | |
| 丙 | 有微溶物生成 | 有白色沉淀生成,反应后溶液呈强碱性 | |
| 丁 | 有白色沉淀生成,溶液呈黄色 | 有红褐色沉淀生成 | 无明显反应,溶液呈黄色 |
回答下列问题:
(1)甲的化学式为
(2)乙在水溶液中的电离方程式为
(3)用离子方程式表示乙溶液与丙溶液反应的实质:
(4)将少量饱和丁溶液滴入沸水中,煮沸至液体呈
(5)乙溶液与丁溶液恰好反应后过滤,检验滤液中主要阴离子的操作是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】实验小组制备 胶体并研究其性质。
胶体并研究其性质。
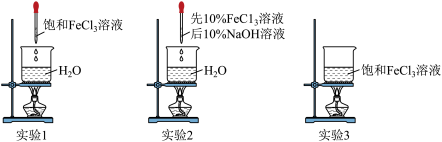
(1)制备 胶体
胶体
①实验1,制备氢氧化铁胶体的化学反应方程式为___________ 。
②实验2与实验1对比,优点是___________ (写出1条即可)
③综合上述实验:制备 胶体提供
胶体提供 的物质可以是
的物质可以是 或
或___________ ,控制反应条件即可制得胶体。
(2) 胶体的性质
胶体的性质
资料:Ⅰ.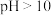 时,
时, 胶体溶解。
胶体溶解。
Ⅱ.固体 易升华(物质从固态不经过液态直接变成气态的过程)。
易升华(物质从固态不经过液态直接变成气态的过程)。
Ⅲ.胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。
实验4:取 实验3得到的液体装入半透膜内,将此半透膜浸入盛蒸馏水的烧杯中。
实验3得到的液体装入半透膜内,将此半透膜浸入盛蒸馏水的烧杯中。

①证明 能透过半透膜的实验操作是:取烧杯中的少量液体,向其中加入稀硝酸,再加入
能透过半透膜的实验操作是:取烧杯中的少量液体,向其中加入稀硝酸,再加入___________ ,若产生___________ ,则证明 能透过半透膜。
能透过半透膜。
②取半透膜袋中的分散系于试管中,逐滴加入 稀溶液,会出现的现象是
稀溶液,会出现的现象是___________ ;最后溶液颜色加深呈黄色,请推测其原因是___________ 。
实验5:取 实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为粘稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体
实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为粘稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体 。
。
③根据资料,推测漏斗内棕褐色的烟中主要含有___________ (填化学式)。
研究表明: 胶体可净化水中的砷酸,砷酸浓度低时以吸附为主,砷酸浓度较高时以反应为主。
胶体可净化水中的砷酸,砷酸浓度低时以吸附为主,砷酸浓度较高时以反应为主。
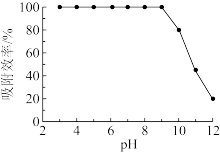
④不同 时,测得溶液中
时,测得溶液中 胶体对砷酸的吸附效率如图,
胶体对砷酸的吸附效率如图, 为
为 时,
时, 胶体对砷酸的吸附效率高,
胶体对砷酸的吸附效率高, 较高时,吸附效率降低的原因是
较高时,吸附效率降低的原因是___________ 。
⑤去除水中高浓度砷酸的原理是 胶体与砷酸反应生成砷酸铁
胶体与砷酸反应生成砷酸铁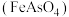 沉淀,化学方程式是
沉淀,化学方程式是___________ 。
 胶体并研究其性质。
胶体并研究其性质。
(1)制备
 胶体
胶体| 实验 | 实验操作 | 丁达尔效应 |
| 1 | 向40mL沸腾的蒸馏水中滴入5滴饱和 溶液(浓度约为30%) 溶液(浓度约为30%) | 迅速出现 |
| 2 | 向40mL蒸馏水中滴入5滴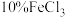 溶液,然后滴入1滴 溶液,然后滴入1滴 溶液,边滴边搅拌 溶液,边滴边搅拌 | 迅速出现 |
| 3 | 加热40mL饱和 溶液 溶液 | 一段时间后出现 |
②实验2与实验1对比,优点是
③综合上述实验:制备
 胶体提供
胶体提供 的物质可以是
的物质可以是 或
或(2)
 胶体的性质
胶体的性质资料:Ⅰ.
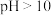 时,
时, 胶体溶解。
胶体溶解。Ⅱ.固体
 易升华(物质从固态不经过液态直接变成气态的过程)。
易升华(物质从固态不经过液态直接变成气态的过程)。Ⅲ.胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。
实验4:取
 实验3得到的液体装入半透膜内,将此半透膜浸入盛蒸馏水的烧杯中。
实验3得到的液体装入半透膜内,将此半透膜浸入盛蒸馏水的烧杯中。
①证明
 能透过半透膜的实验操作是:取烧杯中的少量液体,向其中加入稀硝酸,再加入
能透过半透膜的实验操作是:取烧杯中的少量液体,向其中加入稀硝酸,再加入 能透过半透膜。
能透过半透膜。②取半透膜袋中的分散系于试管中,逐滴加入
 稀溶液,会出现的现象是
稀溶液,会出现的现象是实验5:取
 实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为粘稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体
实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为粘稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体 。
。③根据资料,推测漏斗内棕褐色的烟中主要含有
研究表明:
 胶体可净化水中的砷酸,砷酸浓度低时以吸附为主,砷酸浓度较高时以反应为主。
胶体可净化水中的砷酸,砷酸浓度低时以吸附为主,砷酸浓度较高时以反应为主。④不同
 时,测得溶液中
时,测得溶液中 胶体对砷酸的吸附效率如图,
胶体对砷酸的吸附效率如图, 为
为 时,
时, 胶体对砷酸的吸附效率高,
胶体对砷酸的吸附效率高, 较高时,吸附效率降低的原因是
较高时,吸附效率降低的原因是⑤去除水中高浓度砷酸的原理是
 胶体与砷酸反应生成砷酸铁
胶体与砷酸反应生成砷酸铁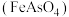 沉淀,化学方程式是
沉淀,化学方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】回答下列问题
(1)现有以下物质:a.NaOH溶液,b.液氨,c.Ba(OH)2固体,d.NaHSO4,e.Fe(OH)3胶体,f.铜,g.CO2,h.CH3COOH。
①以上物质中属于电解质的是___________ (填字母)。
②写出d在熔融时的电离方程式:___________ 。
③在d的水溶液中加入过量c的水溶液,发生反应的离子方程式为___________ 。
(2)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4,再用KMnO4溶液滴定。
①高锰酸钾(硫酸酸化)溶液和草酸溶液的反应的化学方程式为:___________ ;
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是___________ 。
(3)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________ 。
(4)①钢铁在自然界中发生电化学腐蚀时的负极反应式为___________ ;
②碱性条件下,甲醇空气燃料电池的负极反应式为___________ 。
(1)现有以下物质:a.NaOH溶液,b.液氨,c.Ba(OH)2固体,d.NaHSO4,e.Fe(OH)3胶体,f.铜,g.CO2,h.CH3COOH。
①以上物质中属于电解质的是
②写出d在熔融时的电离方程式:
③在d的水溶液中加入过量c的水溶液,发生反应的离子方程式为
(2)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4,再用KMnO4溶液滴定。
①高锰酸钾(硫酸酸化)溶液和草酸溶液的反应的化学方程式为:
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是
(3)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为
(4)①钢铁在自然界中发生电化学腐蚀时的负极反应式为
②碱性条件下,甲醇空气燃料电池的负极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】今有9种物质:①Na ②稀硝酸 ③固态醋酸 ④NH3 ⑤空气 ⑥CO2 ⑦Fe(OH)3胶体 ⑧NaCl晶体 ⑨BaCO3
(1)能导电的物质______ ;(用序号填空,下同)
(2)强电解质_______ ;
(3)非电解质_______ ;
(4)区分Fe(OH)3胶体和FeCl3溶液实验方法______ ;
(5)写出②和⑨反应的离子方程式_______ .
(6)2019年我国在航天领域取得举世瞩目的成就。
2019年12月27日“胖五”在文昌航天发射场顺利升空。“胖五”的燃料系统大部分是以-183℃的液氧(①)为氧化剂、-253℃的液氢(②)为燃料——这已经接近低温的极限,所以又称为“冰箭”。“胖五”的动力心脏——大推力氢氧发动机和液氧煤油发动机都是全新研制的。
2019年3月10日我国长征三号乙运载火箭在西昌卫星发射中心完成第300次发射。长征三号乙运载火箭的一子级上部是装有液体四氧化二氮(N2O4)(③)的氧化剂箱,下部是装有液体偏二甲肼[(CH3)2NNH2](④)的燃料箱。
2019年1月3日嫦娥四号探测器成功着陆在月球背面,嫦娥四号探测器主体部分使用钛合金(⑤)等新材料,太空舱中利用NiFeO4(⑥)和其他物质转化呼出的二氧化碳(⑦)等废气。
上述短文标有序号的物质中,属于混合物的是________ ,属于单质的是________ ,属于氧化物的是________ ,其主要成分属于有机物的是______ ,属于盐的是________ 。(填序号)
(1)能导电的物质
(2)强电解质
(3)非电解质
(4)区分Fe(OH)3胶体和FeCl3溶液实验方法
(5)写出②和⑨反应的离子方程式
(6)2019年我国在航天领域取得举世瞩目的成就。
2019年12月27日“胖五”在文昌航天发射场顺利升空。“胖五”的燃料系统大部分是以-183℃的液氧(①)为氧化剂、-253℃的液氢(②)为燃料——这已经接近低温的极限,所以又称为“冰箭”。“胖五”的动力心脏——大推力氢氧发动机和液氧煤油发动机都是全新研制的。
2019年3月10日我国长征三号乙运载火箭在西昌卫星发射中心完成第300次发射。长征三号乙运载火箭的一子级上部是装有液体四氧化二氮(N2O4)(③)的氧化剂箱,下部是装有液体偏二甲肼[(CH3)2NNH2](④)的燃料箱。
2019年1月3日嫦娥四号探测器成功着陆在月球背面,嫦娥四号探测器主体部分使用钛合金(⑤)等新材料,太空舱中利用NiFeO4(⑥)和其他物质转化呼出的二氧化碳(⑦)等废气。
上述短文标有序号的物质中,属于混合物的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】I.下列均为中学化学中常见的物质:①明矾、②氯化铁溶液、③水玻璃、④纯碱、⑤硅酸钠、⑥过氧化钠、⑦小苏打、⑧干冰。
(1)属于电解质的有___________ (填序号)。
(2)写出⑥的电子式___________ ,利用上述物质证明碳酸酸性比硅酸强的化学方程式为___________ 。
(3)明矾净水的原理是___________ 。
II.在Na+浓度为0.5mol·L-1的某澄清溶液中,还可能含有K+、Ag+、Ba2+、 、
、 、
、 等离子,取该溶液100mL进行下图连续实验(所加试剂均过量、气体全部逸出)。
等离子,取该溶液100mL进行下图连续实验(所加试剂均过量、气体全部逸出)。
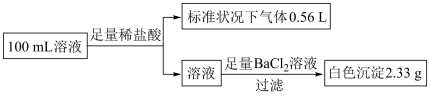
(4)该溶液中除Na+外,肯定不存在的离子是___________ (填离子符号,下同),肯定存在的离子是___________ ,可能存在的离子是___________ 。
(5)若要确定可能存在的离子一定存在,必须满足的条件是___________ 。
(1)属于电解质的有
(2)写出⑥的电子式
(3)明矾净水的原理是
II.在Na+浓度为0.5mol·L-1的某澄清溶液中,还可能含有K+、Ag+、Ba2+、
 、
、 、
、 等离子,取该溶液100mL进行下图连续实验(所加试剂均过量、气体全部逸出)。
等离子,取该溶液100mL进行下图连续实验(所加试剂均过量、气体全部逸出)。
(4)该溶液中除Na+外,肯定不存在的离子是
(5)若要确定可能存在的离子一定存在,必须满足的条件是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的花肥的主要成分及性质。首先对该花肥的主要成分进行了如下假设:
a.只含有 b.含有
b.含有 和
和 c.只含有
c.只含有
将花肥固体粉末溶于水中得到溶液 ,然后进行如下实验:
,然后进行如下实验:
(1)提出假设 的依据是
的依据是___________ (用离子方程式表示)。
(2)实验Ⅰ的预期现象是先产生白色沉淀,然后变成灰绿色,最后变成红褐色沉淀,产生该预期现象的依据是___________ (用化学方程式和离子方程式表示)。
(3)实验Ⅱ中所加试剂的名称是___________ ,由此得出的结论是___________ 。
(4)为进一步验证假设,该小组同学进行了如下实验:
实验Ⅳ中新制氯水参加反应的离子方程式是___________ 。
(5)通过以上实验,可得到的结论是___________ 。还可以通过实验___________ 证明 的存在(填具体的操作及现象)。
的存在(填具体的操作及现象)。
a.只含有
 b.含有
b.含有 和
和 c.只含有
c.只含有
将花肥固体粉末溶于水中得到溶液
 ,然后进行如下实验:
,然后进行如下实验:| 实验序号 | 操作 | 现象 |
| Ⅰ | 取 溶液 溶液 ,加入 ,加入 的 的 溶液 溶液 | 产生红褐色沉淀 |
| Ⅱ | 取 溶液 溶液 ,加入1滴___________溶液 ,加入1滴___________溶液 | 溶液显红色 |
 的依据是
的依据是(2)实验Ⅰ的预期现象是先产生白色沉淀,然后变成灰绿色,最后变成红褐色沉淀,产生该预期现象的依据是
(3)实验Ⅱ中所加试剂的名称是
(4)为进一步验证假设,该小组同学进行了如下实验:
| 实验序号 | 操作 | 现象 |
| Ⅲ | 取 溶液 溶液 ,加入1滴 ,加入1滴 溶液,再加入 溶液,再加入 水 水 | 溶液显红色 |
| Ⅳ | 取 溶液 溶液 ,加入1滴 ,加入1滴 溶液,再加入 溶液,再加入 新制氯水 新制氯水 | 溶液显红色,且颜色比实验而的深 |
(5)通过以上实验,可得到的结论是
 的存在(填具体的操作及现象)。
的存在(填具体的操作及现象)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】钯(Pd)是一种不活泼金属,具有优良的吸氢功能,其氢氧化物具有两性。工业上采用如图流程从二氯二氨合钯[Pd(NH3)2Cl2]中提取钯。
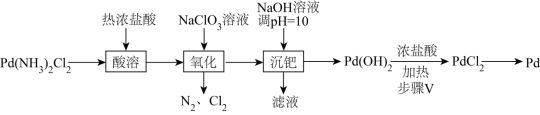
(1)Pd(NH3)2Cl2中钯元素的化合价为____ 。
(2)“酸溶”生成(NH4)2PdCl4,则该反应的化学反应方程式为___ 。
(3)“氧化”后,钯仍以PdCl 形式存在,则“氧化”过程中发生的氧化还原的离子反应方程式为
形式存在,则“氧化”过程中发生的氧化还原的离子反应方程式为____ ,____ 。
(4)“滤液”中含有的阴离子主要是____ ,“沉钯”时,若pH大于10,则上层清液中钯含量升高,其原因为____ 。
(5)“步骤Ⅴ”中需加浓盐酸并加热至100℃浓缩直至蒸干,加浓盐酸的目的是___ 。
(6)已知金属钯密度为12.0g•cm-3,标准状况下,吸附的氢气是其体积的850倍,则此条件下钯的吸附容量R=____ mL•g-1【R为单位质量(g)的钯所吸附氢气的体积(mL),结果保留一位小数】。

(1)Pd(NH3)2Cl2中钯元素的化合价为
(2)“酸溶”生成(NH4)2PdCl4,则该反应的化学反应方程式为
(3)“氧化”后,钯仍以PdCl
 形式存在,则“氧化”过程中发生的氧化还原的离子反应方程式为
形式存在,则“氧化”过程中发生的氧化还原的离子反应方程式为(4)“滤液”中含有的阴离子主要是
(5)“步骤Ⅴ”中需加浓盐酸并加热至100℃浓缩直至蒸干,加浓盐酸的目的是
(6)已知金属钯密度为12.0g•cm-3,标准状况下,吸附的氢气是其体积的850倍,则此条件下钯的吸附容量R=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】ZnO有优异的常温发光性能,在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中均有应用。工业上利用锌焙砂(主要成分为ZnO、ZnFe2O4,还含有Fe3O4、Al2O3、SiO2等)制取氧化锌的工艺流程如图所示:
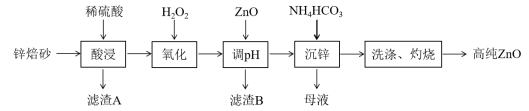
已知:相关金属离子c(Mn+)=0.1 mol·L-1生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)ZnFe2O4可写出ZnO·Fe2O3,则ZnFe2O4与H2SO4反应的化学方程式___________ ;“酸浸”时为了提高浸取速率,可以采取的措施是___________ (任写一种)。
(2)“氧化”步骤中发生的离子方程式为___________ ,H2O2的实际用量比理论用量要大,原因是___________ 。
(3)滤渣B的主要成分为___________ ;加ZnO时,为了不生成Zn(OH)2,该步骤需要控制溶液pH的范围是___________ ;若室温下将溶液的pH调为4,则此时Fe3+的浓度为___________ (已知Ksp[Fe(OH)3]=4×10−38)。
(4)“沉锌”反应中,往滤液加入NH4HCO3溶液,生成ZnCO3·Zn(OH)2及CO2,写出相应的离子方程式___________ 。“沉锌”后的母液可进一步处理,获得一种化工原料,写出该原料在生产中的一种用途___________ 。

已知:相关金属离子c(Mn+)=0.1 mol·L-1生成氢氧化物沉淀的pH如下表所示:
| Fe2+ | Fe3+ | Al3+ | Zn2+ | |
| 开始沉淀 | 6.5 | 2.7 | 3.4 | 6.5 |
| 沉淀完全 | 9.7 | 3.7 | 4.7 | 8.5 |
(1)ZnFe2O4可写出ZnO·Fe2O3,则ZnFe2O4与H2SO4反应的化学方程式
(2)“氧化”步骤中发生的离子方程式为
(3)滤渣B的主要成分为
(4)“沉锌”反应中,往滤液加入NH4HCO3溶液,生成ZnCO3·Zn(OH)2及CO2,写出相应的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】有一包白色粉末,可能含有① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ 中的一种或几种。
中的一种或几种。
实验步骤如下:
ⅰ.取少量固体投入水中,既有气体生成,又有沉淀产生。
ⅱ.过滤,取少量滤液加 溶液,无沉淀产生。
溶液,无沉淀产生。
ⅲ.另取少量滤液,加入足量 溶液,也无沉淀产生。
溶液,也无沉淀产生。
(1)推断白色粉末中一定有___________ (填序号),一定没有___________ (填序号)。
(2)请写出实验步骤ⅰ中产生气体的离子方程式:___________ 。
(3)请写出实验步骤ⅰ中产生沉淀的离子方程式:___________ 。
(4)写出③在水溶液中的电离方程式:___________ 。
 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ 中的一种或几种。
中的一种或几种。实验步骤如下:
ⅰ.取少量固体投入水中,既有气体生成,又有沉淀产生。
ⅱ.过滤,取少量滤液加
 溶液,无沉淀产生。
溶液,无沉淀产生。ⅲ.另取少量滤液,加入足量
 溶液,也无沉淀产生。
溶液,也无沉淀产生。(1)推断白色粉末中一定有
(2)请写出实验步骤ⅰ中产生气体的离子方程式:
(3)请写出实验步骤ⅰ中产生沉淀的离子方程式:
(4)写出③在水溶液中的电离方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】某溶液无色、澄清,对该溶液初步分析后发现其中可能含有SO 、Na+、CO
、Na+、CO 、OH-、K+、Cl-中的若干种,然后又做了如下实验:
、OH-、K+、Cl-中的若干种,然后又做了如下实验:
①用紫色石蕊溶液测定溶液的酸碱性,结果紫色石蕊溶液显蓝色;
②取2mL溶液,加入BaCl2溶液和稀盐酸,生成了白色沉淀,没有产生气泡;
③将②中所得的混合物充分静置后,取上层澄清的液体,加入AgNO3溶液和稀硫酸,生成了白色沉淀。
(1)由上述实验可知:溶液中一定存在的离子是_____ (填离子符号,下同);一定不存在的离子是_____ ,原因是_____ (用离子方程式表示)。
(2)在上述实验操作中,有错误的步骤是_____ (填序号),原因是_____ 。
(3)改正实验操作后,仍生成白色沉淀,则接下来可以用_____ (用本章学过的方法)方法验证溶液中剩余未检验的离子。
 、Na+、CO
、Na+、CO 、OH-、K+、Cl-中的若干种,然后又做了如下实验:
、OH-、K+、Cl-中的若干种,然后又做了如下实验:①用紫色石蕊溶液测定溶液的酸碱性,结果紫色石蕊溶液显蓝色;
②取2mL溶液,加入BaCl2溶液和稀盐酸,生成了白色沉淀,没有产生气泡;
③将②中所得的混合物充分静置后,取上层澄清的液体,加入AgNO3溶液和稀硫酸,生成了白色沉淀。
(1)由上述实验可知:溶液中一定存在的离子是
(2)在上述实验操作中,有错误的步骤是
(3)改正实验操作后,仍生成白色沉淀,则接下来可以用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】 是实验室中的常用试剂,工业上可用作氧化剂、防腐剂、除臭剂、杀菌剂、漂白剂等,该物质保存不当时易变质。某化学学习小组成员以实验室中标有“过氧化钠”的试剂为对象进行实验。
是实验室中的常用试剂,工业上可用作氧化剂、防腐剂、除臭剂、杀菌剂、漂白剂等,该物质保存不当时易变质。某化学学习小组成员以实验室中标有“过氧化钠”的试剂为对象进行实验。
回答下列问题:
1.对该“试剂”的组成进行探究:
实验小组成员取出该标有“过氧化钠”的试剂瓶中的试剂,观察其外部特征:主要为块状、白色,用研钵捣碎块状物,可观察到内部呈淡黄色。
(1)实验室制备 的化学方程式为
的化学方程式为________ .
(2)猜想块状物外层白色物质的组成:
猜想1:只有 ;
;
猜想2:只有 ;
;
猜想3:有 和
和 。
。
用化学方程式解释猜想1的原因:________ .
(3)设计实验并得出结论:
可选用试剂: 溶液、
溶液、 溶液、
溶液、 溶液
溶液
Ⅱ.学习小组成员继续采用下图装置,测定一块质量为m克的上述“试剂”中过氧化钠的质量分数。

(4)装置乙的作用是________ .
(5)装置丁中液面与装置丙中液面高度相同时(忽略 在水中的溶解),测得量筒中水的体积折算成氧气的质量为a克,则混合物中过氧化钠的质量分数为
在水中的溶解),测得量筒中水的体积折算成氧气的质量为a克,则混合物中过氧化钠的质量分数为________ 。
 是实验室中的常用试剂,工业上可用作氧化剂、防腐剂、除臭剂、杀菌剂、漂白剂等,该物质保存不当时易变质。某化学学习小组成员以实验室中标有“过氧化钠”的试剂为对象进行实验。
是实验室中的常用试剂,工业上可用作氧化剂、防腐剂、除臭剂、杀菌剂、漂白剂等,该物质保存不当时易变质。某化学学习小组成员以实验室中标有“过氧化钠”的试剂为对象进行实验。回答下列问题:
1.对该“试剂”的组成进行探究:
实验小组成员取出该标有“过氧化钠”的试剂瓶中的试剂,观察其外部特征:主要为块状、白色,用研钵捣碎块状物,可观察到内部呈淡黄色。
(1)实验室制备
 的化学方程式为
的化学方程式为(2)猜想块状物外层白色物质的组成:
猜想1:只有
 ;
;猜想2:只有
 ;
;猜想3:有
 和
和 。
。用化学方程式解释猜想1的原因:
(3)设计实验并得出结论:
可选用试剂:
 溶液、
溶液、 溶液、
溶液、 溶液
溶液| 序号 | 实验步骤 | 实验现象 | 结论或解析 |
| 1 | ①取少量上述白色物质,加入到盛有稀盐酸的试管 | a | “猜想1”不成立 |
| 2 | ②取少量上述白色物质溶于水,向其中加入过量的b | 产生白色沉淀 | 所涉及的离子方程式:c |
| ③过滤②所得混合物,向滤液中滴加几滴酚酞 | 溶液不变红 | “猜想d |
Ⅱ.学习小组成员继续采用下图装置,测定一块质量为m克的上述“试剂”中过氧化钠的质量分数。

(4)装置乙的作用是
(5)装置丁中液面与装置丙中液面高度相同时(忽略
 在水中的溶解),测得量筒中水的体积折算成氧气的质量为a克,则混合物中过氧化钠的质量分数为
在水中的溶解),测得量筒中水的体积折算成氧气的质量为a克,则混合物中过氧化钠的质量分数为
您最近一年使用:0次



