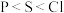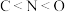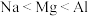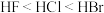关于碱金属元素和卤族元素的下列说法错误的是
| A.由于钠和钾的原子结构极为相似,所以它们对应的碱都是强碱 |
| B.通过钠与钾分别与水反应的剧烈程度可知,碱金属原子核电荷数越多,金属性越强 |
| C.通过卤族单质与氢气反应所需要的反应条件,可以判断氯的非金属性比溴强 |
| D.卤族元素对应的氢化物的稳定性从强到弱的顺序为:HF<HCl<HBr<HI |
更新时间:2024-04-05 21:27:40
|
相似题推荐
单选题
|
较易
(0.85)
解题方法
【推荐1】X、Y、Z、M、N代表五种金属,有以下化学反应:①水溶液中:X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;③Y可以溶于稀H2SO4中,M不被稀H2SO4氧化;④M、N为电极与稀硫酸构成原电池,电子从M极流出。则这五种金属的活泼性由弱到强的顺序是
| A.M<N<Y<X<Z | B.N<M<X<Y<Z |
| C.N<M<Y<X<Z | D.X<Z<N<M<Y |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】能说明Cl的非金属性比S的非金属性强的事实是( )
| A.Cl2与H2反应生成HCl,而S与H2反应生成H2S |
| B.Cl原子最外电子层上有7个电子,而S原子最外层上有6个电子 |
| C.Cl2 能与水反应而S不与水反应 |
| D.向H2S 的水溶液中通入Cl2可得到淡黄色的固体 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】科学家根据元素周期系绘制出多种元素周期表,下列关于元素在周期表中的位置与物质性质关系正确的是
| A.F、Cl、Br、I同主族,非金属性逐渐减弱,故氢化物酸性逐渐减弱 |
| B.P、S、Cl同周期,非金属性递增,故氧化物对应水化物的酸性逐渐增强 |
| C.短周期中,NaOH碱性最强,非金属氢化物中HF最稳定 |
| D.Al和Si位于金属元素和非金属元素的分界线处,故都是很好的半导体材料 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的
| A.质子数:c>d,离子的还原性:Y2->Z- |
| B.电负性:Z>Y>W>X |
| C.原子半径:X<W<Y<Z |
| D.氢化物的稳定性:H2Y>HZ |
您最近一年使用:0次