人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。请根据题中提供的信息,回答下列问题:
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_____。
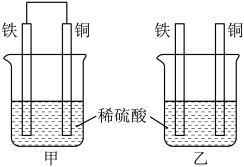
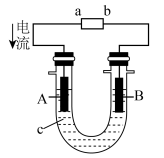
(2)将纯铁片和纯铜片按图甲、乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:_____ 。
A.甲中铜片质量减少、乙中铁片质量减少 B.甲、乙均为化学能转变为电能的装置
C.乙中铜片上没有明显变化 D.甲、乙两烧杯中 均减小
均减小
②在相同时间内,两烧杯中产生气泡的速度:甲_____ 乙(填“>”、“<”或“=”)。
③请写出甲、乙中构成原电池的正极电极反应式:_____ 。电池工作时,溶液中 向
向_____ 极(填“正”或“负”)移动。当甲中溶液质量增重27g时,电极上转移电子数目为_____ 。
④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为_____ 。
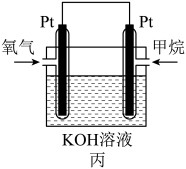
(3)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH.通甲烷一极是电池的____ 极,电极反应为______ 。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_____。
A. 与 与 反应 反应 | B. 与 与 燃烧反应 燃烧反应 |
C.灼热的炭与 反应 反应 | D.氢氧化钠与稀盐酸反应 |
(2)将纯铁片和纯铜片按图甲、乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
A.甲中铜片质量减少、乙中铁片质量减少 B.甲、乙均为化学能转变为电能的装置
C.乙中铜片上没有明显变化 D.甲、乙两烧杯中
 均减小
均减小②在相同时间内,两烧杯中产生气泡的速度:甲
③请写出甲、乙中构成原电池的正极电极反应式:
 向
向④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为
(3)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH.通甲烷一极是电池的
更新时间:2024-05-01 20:09:31
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】I.物质中的化学能在一定条件下可转化为电能。
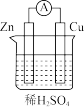
(1)将锌片放入盛有稀硫酸的烧杯中,反应的离子方程式是_________________ 。
(2)将锌片、铜片按照图所示装置连接,能证明化学能转化为电能的实验现象是:铜片上有气泡产生、_ 。
(3)稀硫酸在如图所示装置中的作用是:传导离子、__________________ 。
(4)下列反应通过原电池装置,可实现化学能直接转化为电能的是______ (填序号)。
① CaO+H2O = Ca(OH) 2
② 2H2+O2 = 2H2O
③ Cu+2Ag+ = Cu2++ 2Ag
Ⅱ.
(5)纽扣式微型银锌电池广泛的应用于电子表和电子计算器中,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2。其正极的电极反应式:______ ,工作时电池电解质溶液的碱性___ (填“增强”、“减弱”或“不变”)。
Ⅲ.固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。
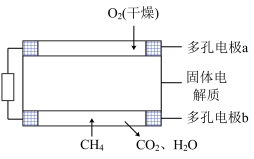
(6)a电极为电池的______ 极,固体电解质中的阳离子向_______ 极移动;
(7)b电极的电极反应式为:________________________ ;
(8)电池的总反应方程式为:___________________________ 。当电路中有2mol电子转移时,理论上负极消耗的气体在标况下的体积是_________ L。

(1)将锌片放入盛有稀硫酸的烧杯中,反应的离子方程式是
(2)将锌片、铜片按照图所示装置连接,能证明化学能转化为电能的实验现象是:铜片上有气泡产生、
(3)稀硫酸在如图所示装置中的作用是:传导离子、
(4)下列反应通过原电池装置,可实现化学能直接转化为电能的是
① CaO+H2O = Ca(OH) 2
② 2H2+O2 = 2H2O
③ Cu+2Ag+ = Cu2++ 2Ag
Ⅱ.
(5)纽扣式微型银锌电池广泛的应用于电子表和电子计算器中,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2。其正极的电极反应式:
Ⅲ.固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。

(6)a电极为电池的
(7)b电极的电极反应式为:
(8)电池的总反应方程式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。

①该电池放电时正极产生红褐色物质,写出正极的电极反应式为_________ 。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______ (填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________ (填“左”或“右”)移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有____________ 。
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式是_____ ,A是________ 。

(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________ (填“从a到b”或“从b到a”),负极发生的电极反应式为____________ 。


①该电池放电时正极产生红褐色物质,写出正极的电极反应式为
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式是

(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】现用蓄电池Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾(K2FeO4)。反应装置如图所示:
Fe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾(K2FeO4)。反应装置如图所示:

(1)电解时,石墨电极连接的a极上放电的物质为__________ (填“Fe”或“NiO2”)。
(2)写出电解池中铁电极发生的电极反应式__________ 。
(3)当消耗掉0.1 mol NiO2时,生成高铁酸钾__________ g。
(4)Mg和Fe都是生产生活中的常用金属。加热锅炉时,水中的MgCO3可以先转化为Mg(HCO3)2,然后转化为Mg(OH)2,求MgCO3+H2O⇌Mg2++ +OH-在80℃时的平衡常数
+OH-在80℃时的平衡常数__________ 。(已知:80℃时H2O的Kw=2.5×10−13,Ksp(MgCO3)=8.4×10−6,Ka1(H2CO3)=4.2×10−7、Ka2(H2CO3)=5.6×10−11)。
 Fe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾(K2FeO4)。反应装置如图所示:
Fe(OH)2+Ni(OH)2为电源,制取少量高铁酸钾(K2FeO4)。反应装置如图所示:
(1)电解时,石墨电极连接的a极上放电的物质为
(2)写出电解池中铁电极发生的电极反应式
(3)当消耗掉0.1 mol NiO2时,生成高铁酸钾
(4)Mg和Fe都是生产生活中的常用金属。加热锅炉时,水中的MgCO3可以先转化为Mg(HCO3)2,然后转化为Mg(OH)2,求MgCO3+H2O⇌Mg2++
 +OH-在80℃时的平衡常数
+OH-在80℃时的平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】氧化和还原是认识物质性质、分析化学变化的重要视角之一,对生产、生活乃至生命活动中有着十分重要的作用。
(1)下列物质间的转化,需要加入氧化剂才能实现的是_____。
(2)下列溶液中的离子因发生氧化还原反应而不能大量共存的是_____。
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2
①配平下列化学方程式并标出电子转移方向和个数。_____
_____NaIO3+_____NaHSO3—_____I2+_____Na2SO4+_____H2SO4+_____H2O
②在该反应中NaHSO3体现_____ (填“氧化性”或“还原性”),I2为_____ (填“氧化产物”或“还原产物”)。
③已知: 、I2、I-、
、I2、I-、 和一些未知物组成的一个氧化还原反应,其中
和一些未知物组成的一个氧化还原反应,其中 是氧化产物,该反应中还原性
是氧化产物,该反应中还原性
_____ I-(填“>”或“<”),写出该反应的化学方程式_____ 。
化学能与电能之间的转化,是能量转化的重要形式之一,对于生产与生活有很多。

(4)汽车的启动电源常用铅酸蓄电池。其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列叙述中正确的是_____。
(5)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是_____。
(6)用如图装置可以模拟铁的电化学防护,下列说法不正确的是_____。

(7)如图是乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料是石墨和铁中的一种,工作时M、N两个电极的质量都不减少
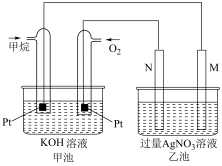
①甲池中通入乙醇的铂电极名称是_____ (选填“正极”、“负极”、“阴极”、“阳极”),通入O2的铂电极反应式为_____ 。
②乙池属于_____ (填“原电池”或“电解池”),工作时,乙池中电子流出的电极是_____ (选填“M”或N”);
③若乙池中某电极析出金属银4.32g时,甲池中理论上消耗氧气为_____ L(标况下);
④若用电解方法精炼粗铜,乙池电解液选用CuSO4溶液,则N电极的材料是_____ (选填“粗铜”或“精铜”),反应一段时间以后,电解液溶液的浓度_____ 。(选填“增大”、“减小”“不变”)
(1)下列物质间的转化,需要加入氧化剂才能实现的是_____。
| A.NH3→NO | B.Fe2O3→Fe |
| C.KClO3→Cl2 | D.H2SO4→SO2 |
(2)下列溶液中的离子因发生氧化还原反应而不能大量共存的是_____。
A.Fe2+、H+、 、 、 |
B.Cu2+、Al3+、 、Cl- 、Cl- |
C.K+、Al3+、OH-、 |
D.Ba2+、Na+、 、ClO- 、ClO- |
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2
①配平下列化学方程式并标出电子转移方向和个数。
_____NaIO3+_____NaHSO3—_____I2+_____Na2SO4+_____H2SO4+_____H2O
②在该反应中NaHSO3体现
③已知:
 、I2、I-、
、I2、I-、 和一些未知物组成的一个氧化还原反应,其中
和一些未知物组成的一个氧化还原反应,其中 是氧化产物,该反应中还原性
是氧化产物,该反应中还原性
化学能与电能之间的转化,是能量转化的重要形式之一,对于生产与生活有很多。

(4)汽车的启动电源常用铅酸蓄电池。其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列叙述中正确的是_____。
| A.PbO2是电池的负极 |
| B.Pb是负极 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
(5)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是_____。
| A.防腐原理主要是避免发生反应:2Fe+O2+2H2O=2Fe(OH)2 |
| B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池 |
| C.采用外加电流的阴极保护时需外接镁、锌等作辅助阳极 |
| D.钢构件可采用不锈钢材料以减缓电化学腐蚀 |
(6)用如图装置可以模拟铁的电化学防护,下列说法不正确的是_____。

| A.若X为碳棒,开关K置于A处时,铁电极反应2H2O+2e-=H2+2OH- |
| B.若X为碳棒,开关K置于A处可以减缓铁的腐蚀 |
| C.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀 |
| D.若X为锌棒,开关K置于B处时,铁电极反应为2H++2e-=H2 |
(7)如图是乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料是石墨和铁中的一种,工作时M、N两个电极的质量都不减少

①甲池中通入乙醇的铂电极名称是
②乙池属于
③若乙池中某电极析出金属银4.32g时,甲池中理论上消耗氧气为
④若用电解方法精炼粗铜,乙池电解液选用CuSO4溶液,则N电极的材料是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】如图所示,某同学设计一个甲醚( )燃料电池并探究氯碱工业和粗铜精炼的原理,其中乙装置中X为阳离子交换膜。
)燃料电池并探究氯碱工业和粗铜精炼的原理,其中乙装置中X为阳离子交换膜。
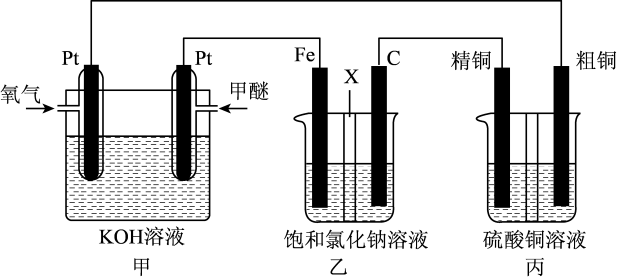
根据要求回答相关问题:
(1)甲装置是_______ 装置(填“电解池”或“原电池”),通 的一极是
的一极是_______ (填“正极”、“负极”、“阴极”或“阳极”),通 一极的电极反应式为
一极的电极反应式为_______ 。
(2)乙装置中石墨电极(C)的电极反应式为_______ 。反应一段时间后,乙装置中主要在_______ (填“铁极”或“石墨极”)区生成氢氧化钠。乙装置中总反应的化学方程式为_______ 。
(3)如果粗铜中含有锌、银、金等杂质,反应一段时间,丙装置中形成阳极泥的成分是_______ (填化学式)。
(4)若甲装置中有2.24 L(标准状况)氧气参加反应,则乙装置中铁电极上生成的气体的物质的量为_______ 。
 )燃料电池并探究氯碱工业和粗铜精炼的原理,其中乙装置中X为阳离子交换膜。
)燃料电池并探究氯碱工业和粗铜精炼的原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)甲装置是
 的一极是
的一极是 一极的电极反应式为
一极的电极反应式为(2)乙装置中石墨电极(C)的电极反应式为
(3)如果粗铜中含有锌、银、金等杂质,反应一段时间,丙装置中形成阳极泥的成分是
(4)若甲装置中有2.24 L(标准状况)氧气参加反应,则乙装置中铁电极上生成的气体的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
I.现有A、B、C、D四种烃,其结构模型如图:

(1)等质量的以上物质完全燃烧时耗去O2的量最多的是____ ;(填分子式,下同),生成CO2的量最多的是____ 。
(2)将1molA和适量的Cl2混合后光照,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为____ mol。
(3)将一定量的A和Cl2混合,光照条件下反应。请写出生成具有正四面体构型的有机产物的化学方程式:____ 。
(4)请你根据甲烷分子的结构推测,有机物D分子中的所有碳原子____ (填“一定”“可能”或“一定不”)在同一平面内。
II.电池在我们的生活中有着重要的应用,请回答下列问题:
(5)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

实验测得OH-向B电极定向移动,则B极的电极反应式为____ 。当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为____ 。
(6)潜艇中使用的液氨液氧燃料电池工作原理如图所示:
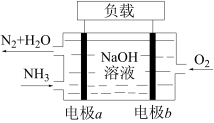
电极a名称是____ (填“正极”或“负极”),其电极反应为____ 。
I.现有A、B、C、D四种烃,其结构模型如图:

(1)等质量的以上物质完全燃烧时耗去O2的量最多的是
(2)将1molA和适量的Cl2混合后光照,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为
(3)将一定量的A和Cl2混合,光照条件下反应。请写出生成具有正四面体构型的有机产物的化学方程式:
(4)请你根据甲烷分子的结构推测,有机物D分子中的所有碳原子
II.电池在我们的生活中有着重要的应用,请回答下列问题:
(5)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

实验测得OH-向B电极定向移动,则B极的电极反应式为
(6)潜艇中使用的液氨液氧燃料电池工作原理如图所示:

电极a名称是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
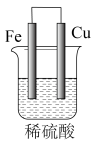
【推荐1】(1)在如图所示的原电池中,___ 是负极,发生___ 反应,正极的现象___ ,电池反应的化学方程式为___ 。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH═K2CO3+3H2O。

①实验测得OH-定向移向B电极,则___ 处电极入口通甲烷(填A或B)。
②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___ 。
(3)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则:
①A电极的材料是___ ,电极反应式是___ ;
②B电极的材料是__ ,电极反应式是___ 。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH═K2CO3+3H2O。

①实验测得OH-定向移向B电极,则
②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
(3)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则:
①A电极的材料是
②B电极的材料是

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】书写下列化学用语:
(1)氯碱工业中电解饱和食盐水总反应的离子方程式________ 。
(2)泡沫灭火器所用的原料为硫酸铝和碳酸氢钠,用离子方程式表示泡沫灭火器的灭火原理________ 。
(3)向含有Mg(OH)2固体的浊液中加入浓NH4Cl溶液,Mg(OH)2固体溶解,用化学方程式解释原因________ 。
(4)以甲烷、空气为燃料,以KOH为电解质溶液的燃料电池,负极反应式________ ,正极反应式________ 。
(5)用惰性电极电解溶融Al2O3可以获得活泼金属Al,写出阳极的电极反应式________ ,总反应的化学方程式________ 。
(1)氯碱工业中电解饱和食盐水总反应的离子方程式
(2)泡沫灭火器所用的原料为硫酸铝和碳酸氢钠,用离子方程式表示泡沫灭火器的灭火原理
(3)向含有Mg(OH)2固体的浊液中加入浓NH4Cl溶液,Mg(OH)2固体溶解,用化学方程式解释原因
(4)以甲烷、空气为燃料,以KOH为电解质溶液的燃料电池,负极反应式
(5)用惰性电极电解溶融Al2O3可以获得活泼金属Al,写出阳极的电极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量___ (填“>”、“<”或“=”)570 kJ
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4 完全燃烧生成CO2气体和H2O(l)的热化学方程式为______________________ 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。

该电池的正极为:__________ (填A或B)。若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为 ____________ 。
(4)如果将上述装置中通往的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:_____________ 。
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4 完全燃烧生成CO2气体和H2O(l)的热化学方程式为
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。

该电池的正极为:
(4)如果将上述装置中通往的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:
您最近一年使用:0次



