研究碳、氮氧化物的性质与利用具有重要意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是________ 。
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为_________________ ;
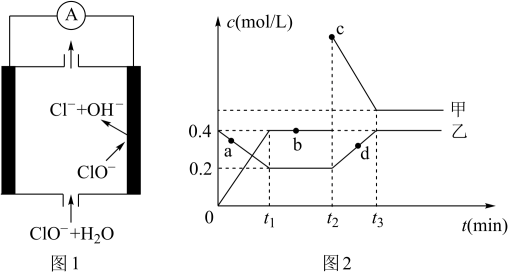
(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是_______________ ;
②图中a、b、c、d四点中,表示反应处于平衡状态的是_________ 。t1~t2时间内v正(乙)_____ v逆(甲)(填“>”“<”或“=”)
③反应进行到t2时刻,改变的条件可能是_____________ 。
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是__________________ 。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为

(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是
②图中a、b、c、d四点中,表示反应处于平衡状态的是
③反应进行到t2时刻,改变的条件可能是
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是
更新时间:2016-12-09 07:22:33
|
【知识点】 化学反应原理综合考查解读
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】工业上可用合成气(主要成分为CO2、H2、CO)在催化剂作用下合成甲醇,并可用甲醇合成甲醚。
(1)CO2的电子式是________ 。
(2)已知:CO(g)+2H2(g) CH3OH(g) △H1 = -90.77 kJ/mol
CH3OH(g) △H1 = -90.77 kJ/mol
CO2 (g)+H2 (g) CO(g)+H2O(g) △H2 = +41.19 kJ/mol
CO(g)+H2O(g) △H2 = +41.19 kJ/mol
则CO2与H2反应制备CH3OH(g)的热化学方程式是________ 。
(3)向三个体积均为1L的恒容密闭容器中分别充入1mol CO2和3mol H2,在不同催化剂作用下同时反应制备CH3OH(g)。测得H2转化率随温度变化的数据如下表所示。
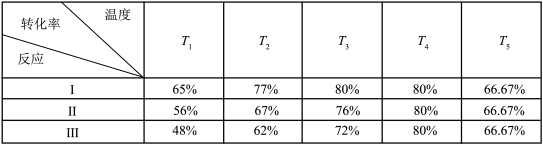
(注:T5时,H2转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________ (填“I”“II”或“III”)。
②T3时,反应I的v(正)________ v(逆)(填“>”“<”或“=”)。
③温度为T5时,该反应的平衡常数K=________ 。
(4)甲醇合成甲醚的反应为2CH3OH(g) CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)
CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g) C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:
C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:
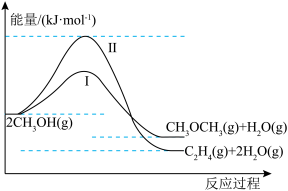
①反应速率较快的是________ (填“Ⅰ”或“Ⅱ”),原因是________ 。
②根据反应原理,分析增大压强对合成甲醚的影响________ 。
(1)CO2的电子式是
(2)已知:CO(g)+2H2(g)
 CH3OH(g) △H1 = -90.77 kJ/mol
CH3OH(g) △H1 = -90.77 kJ/mol CO2 (g)+H2 (g)
 CO(g)+H2O(g) △H2 = +41.19 kJ/mol
CO(g)+H2O(g) △H2 = +41.19 kJ/mol 则CO2与H2反应制备CH3OH(g)的热化学方程式是
(3)向三个体积均为1L的恒容密闭容器中分别充入1mol CO2和3mol H2,在不同催化剂作用下同时反应制备CH3OH(g)。测得H2转化率随温度变化的数据如下表所示。

(注:T5时,H2转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是
②T3时,反应I的v(正)
③温度为T5时,该反应的平衡常数K=
(4)甲醇合成甲醚的反应为2CH3OH(g)
 CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g)
CH3OCH3(g)+H2O(g),反应过程中存在副反应2CH3OH(g) C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:
C2H4(g)+2H2O(g)。反应过程中的能量变化如图所示:
①反应速率较快的是
②根据反应原理,分析增大压强对合成甲醚的影响
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)工业合成氨反应:N2+3H2 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________ (填“大于”、“小于”或“等于”)920kJ。
(2)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3
①则用N2表示的化学反应速率为__________________ 。
②一定条件下,当该反应进行到最大限度时,下列说法正确的是______ (填编号)
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1 : 3 : 2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
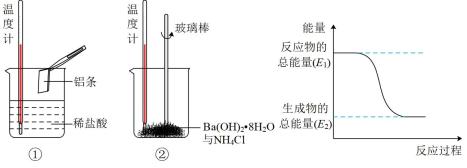
(3)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______ (填“升高”或“降低”)。反应过程____ (填“①”或“②”)的能量变化可用图表示。
(4)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:

①则d电极是____ (填“正极” 或“负极”),c电极的电极反应式为_____________________________ 。
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为______ L。
(1)工业合成氨反应:N2+3H2
 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量(2)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3
①则用N2表示的化学反应速率为
②一定条件下,当该反应进行到最大限度时,下列说法正确的是
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1 : 3 : 2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
(3)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度

(4)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:

①则d电极是
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】回答下列问题。
Ⅰ.生物脱H2S的原理为:
H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
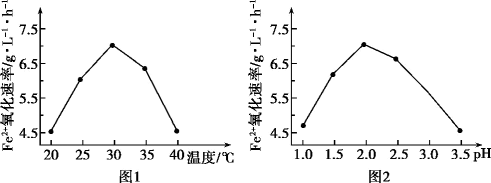
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______ 。
(2)由图1和图2判断使用硫杆菌的最佳条件为_______ 。
Ⅱ.一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如图所示:
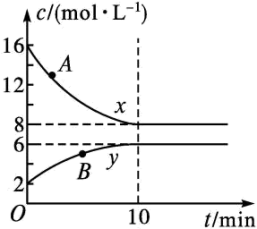
(1)表示NO2浓度变化的曲线是_______ ,写出相应的化学方程式:_______ 。
(2)从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)=_______ ,A、B两点对应状态中,曲线x代表的物质的反应速率相对大小为:v(A)_______ v(B)。
Ⅰ.生物脱H2S的原理为:
H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4
 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是
(2)由图1和图2判断使用硫杆菌的最佳条件为

Ⅱ.一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如图所示:

(1)表示NO2浓度变化的曲线是
(2)从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)=
您最近一年使用:0次



