回答下列问题。
Ⅰ.生物脱H2S的原理为:
H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
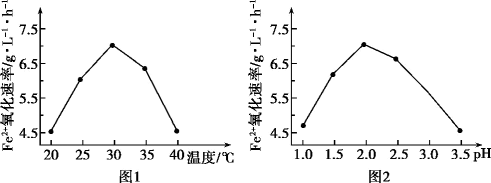
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______ 。
(2)由图1和图2判断使用硫杆菌的最佳条件为_______ 。
Ⅱ.一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如图所示:
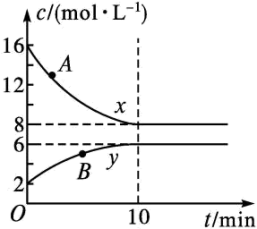
(1)表示NO2浓度变化的曲线是_______ ,写出相应的化学方程式:_______ 。
(2)从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)=_______ ,A、B两点对应状态中,曲线x代表的物质的反应速率相对大小为:v(A)_______ v(B)。
Ⅰ.生物脱H2S的原理为:
H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4
 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是
(2)由图1和图2判断使用硫杆菌的最佳条件为

Ⅱ.一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如图所示:

(1)表示NO2浓度变化的曲线是
(2)从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)=
更新时间:2021-04-30 12:57:51
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①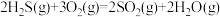 ΔH1=-1036 kJ/mol
ΔH1=-1036 kJ/mol
② ΔH2=+94kJ/mol
ΔH2=+94kJ/mol
③ ΔH3=-484kJ/mol
ΔH3=-484kJ/mol
计算 热分解反应④
热分解反应④ 的
的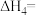
_______  。
。
(2)较普遍采用的H2S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是_______ 。
(3)在1470K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为_______ 。
(4)在1373K、102kPa反应条件下,对于n(H2S):n(Ar)分别为4:1、1:1、1:4、1:9、1:19的H2S-Ar混合气,热分解反应④过程中H2S转化率随时间的变化如下图所示。
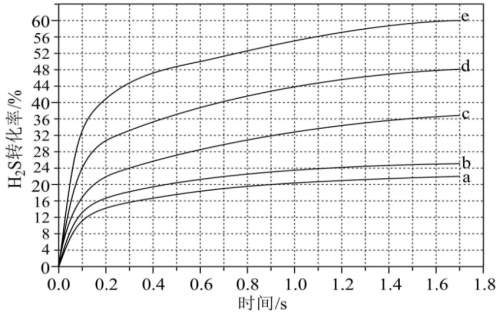
①n(H2S):n(Ar)越小,H2S平衡转化率_______ ,(填“越高”“越低”或“不变”)理由是_______ 。
②当n(H2S):n(Ar)=1:9时,计算其0~0.7s之间(0.7s时a,b,c,d,e转化率分别为0.18,0.22,0.30,0.40,0.51),H2S分压的平均变化率为_______  。
。
(1)已知下列反应的热化学方程式:
①
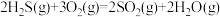 ΔH1=-1036 kJ/mol
ΔH1=-1036 kJ/mol②
 ΔH2=+94kJ/mol
ΔH2=+94kJ/mol③
 ΔH3=-484kJ/mol
ΔH3=-484kJ/mol计算
 热分解反应④
热分解反应④ 的
的
 。
。(2)较普遍采用的H2S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是
(3)在1470K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为
(4)在1373K、102kPa反应条件下,对于n(H2S):n(Ar)分别为4:1、1:1、1:4、1:9、1:19的H2S-Ar混合气,热分解反应④过程中H2S转化率随时间的变化如下图所示。

①n(H2S):n(Ar)越小,H2S平衡转化率
②当n(H2S):n(Ar)=1:9时,计算其0~0.7s之间(0.7s时a,b,c,d,e转化率分别为0.18,0.22,0.30,0.40,0.51),H2S分压的平均变化率为
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂。近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果。比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾。
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:①Fe3++3OH-=Fe(OH)3;②____________________ 。
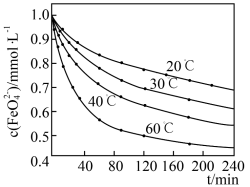
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物。将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4) =1.0mmol·L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO2-4)的变化,结果见下图。高铁酸钾与水反应的离子反应方程式为______ ,该反应的△H_______ 0(填“>”“<”或“=”)。
(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
该电池放电时的负极反应式为__________ ,若外电路有5.418×1022个电子通过,则正极有_________ g高铁酸钾参与反应。
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-2,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL。
①滴定时发生反应的离子方程式为______________________ 。
②原溶液中K2FeO4的浓度为__________________ (用含字母的代数式表示)。
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:①Fe3++3OH-=Fe(OH)3;②
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物。将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4) =1.0mmol·L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO2-4)的变化,结果见下图。高铁酸钾与水反应的离子反应方程式为

(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH该电池放电时的负极反应式为
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-2,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL。
①滴定时发生反应的离子方程式为
②原溶液中K2FeO4的浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】第VA族元素单质及其化合物在生产、生活中有重要的用途。
(1)下列说法正确的是__________ (填序号)。
a.含氧酸的酸性:HNO3>H3PO4>H3AsO4 b.原子半径:S >P>As
c.氢化物的稳定性NH3>PH3> AsH3d.AsH3电子式是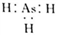
(2)雌黄(As2S3 )和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
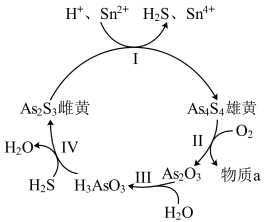
①Ⅱ中若1molAs4S4反应转移28mole-,a物质是__________ 。
②Ⅰ中反应的离子方程式是____________________________________ 。
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示。
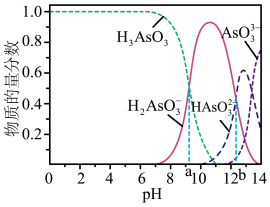
①人体血液的pH在7.35~7.45 之间,用药后人体中含砷元素的主要微粒是___________ 。
②H3AsO3的一级电离常数是6×10-10mol·L-1,n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液的pH=___________ (列出计算式即可)。
(4)由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图所示:
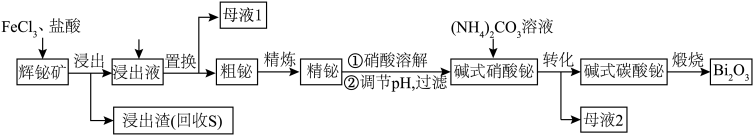
①“浸出”时Bi2S3与FeCl3 溶液反应的离子方程式为________________________________ 。
②“置换”时生成单质铋的离子方程式为____________________________________ 。
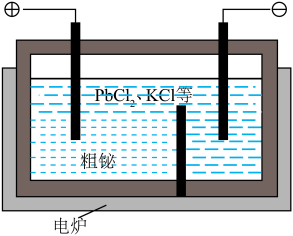
③“粗铋”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,其装置示意图如所示。电解后阳极底部留下的为精铋。写出阳极电极反应的方程式__________________________ 。
(1)下列说法正确的是
a.含氧酸的酸性:HNO3>H3PO4>H3AsO4 b.原子半径:S >P>As
c.氢化物的稳定性NH3>PH3> AsH3d.AsH3电子式是
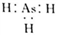
(2)雌黄(As2S3 )和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。

①Ⅱ中若1molAs4S4反应转移28mole-,a物质是
②Ⅰ中反应的离子方程式是
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示。

①人体血液的pH在7.35~7.45 之间,用药后人体中含砷元素的主要微粒是
②H3AsO3的一级电离常数是6×10-10mol·L-1,n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液的pH=
(4)由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图所示:

①“浸出”时Bi2S3与FeCl3 溶液反应的离子方程式为
②“置换”时生成单质铋的离子方程式为
③“粗铋”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,其装置示意图如所示。电解后阳极底部留下的为精铋。写出阳极电极反应的方程式

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以废旧锂离子电池的正极材料(主要含LiCoO2、Al、C等)为原料制备CoC2O4.2H2O的一种实验流程如图:


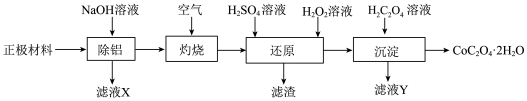
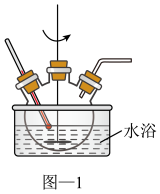
(1)“除铝”可在如图1所示的装置中进行。保持温度、反应物和溶剂的量不变,实验中提高铝的去除率的措施有___ 。
(2)“灼烧”的主要目的是___ 。
(3)“还原”步骤温度在70℃左右,LiCoO2发生反应的化学方程式为___ 。若该步骤用盐酸代替H2SO4和H2O2,也可达到“还原”的目的,但其缺点是___ 。
(4)“沉淀”步骤中,证明Co2+已沉淀完全的实验操作及现象是___ 。
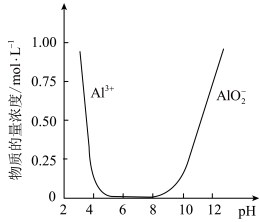
(5)设计由“滤液X”制备纯净的Al2O3的实验方案。(已知含铝物种浓度与pH的关系如图所示。实验中必须使用的试剂:H2SO4溶液、BaCl2溶液、蒸馏水)___ 。



(1)“除铝”可在如图1所示的装置中进行。保持温度、反应物和溶剂的量不变,实验中提高铝的去除率的措施有

(2)“灼烧”的主要目的是
(3)“还原”步骤温度在70℃左右,LiCoO2发生反应的化学方程式为
(4)“沉淀”步骤中,证明Co2+已沉淀完全的实验操作及现象是
(5)设计由“滤液X”制备纯净的Al2O3的实验方案。(已知含铝物种浓度与pH的关系如图所示。实验中必须使用的试剂:H2SO4溶液、BaCl2溶液、蒸馏水)

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】一些行业的废水中氨氮含量严重超标,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点,有多种方法可以去除。
I.电镀行业废水处理流程如下:
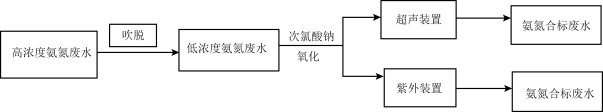
(1)吹脱法除氨氮:水中的氨氮大多数以 和游离态的
和游离态的 保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移,从而达到脱除氨的目的。氨氮废水中
保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移,从而达到脱除氨的目的。氨氮废水中 和
和 平衡态的平衡关系有
平衡态的平衡关系有________ 。
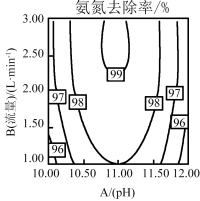
(2)温度、 值、空气流量对脱除氨有很大的影响。
值、空气流量对脱除氨有很大的影响。 值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,
值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,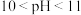 时,吹脱率随着
时,吹脱率随着 增加而增加,请用化学平衡移动原理解释原因
增加而增加,请用化学平衡移动原理解释原因________ 。
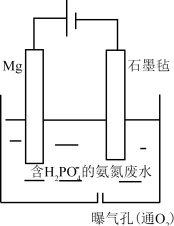
(3)次氯酸钠氧化法:利用次氯酸钠氧化废水中氨氮的离子方程式是________ 。
II.对于含有 的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生
的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生 ,在通入
,在通入 的情况,又产生
的情况,又产生 ,以氧化水中的
,以氧化水中的 ,同时
,同时 还可以通过生成
还可以通过生成 沉淀而持续被除去。
沉淀而持续被除去。
(1)阳极的电极反应式是________ 。
(2)废水中的 转化为
转化为 的离子方程式是
的离子方程式是________ 。
(3) 大于
大于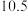 不利于
不利于 的生成,原因是
的生成,原因是________ 。
I.电镀行业废水处理流程如下:

(1)吹脱法除氨氮:水中的氨氮大多数以
 和游离态的
和游离态的 保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移,从而达到脱除氨的目的。氨氮废水中
保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移,从而达到脱除氨的目的。氨氮废水中 和
和 平衡态的平衡关系有
平衡态的平衡关系有(2)温度、
 值、空气流量对脱除氨有很大的影响。
值、空气流量对脱除氨有很大的影响。 值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,
值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,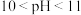 时,吹脱率随着
时,吹脱率随着 增加而增加,请用化学平衡移动原理解释原因
增加而增加,请用化学平衡移动原理解释原因
(3)次氯酸钠氧化法:利用次氯酸钠氧化废水中氨氮的离子方程式是
II.对于含有
 的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生
的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生 ,在通入
,在通入 的情况,又产生
的情况,又产生 ,以氧化水中的
,以氧化水中的 ,同时
,同时 还可以通过生成
还可以通过生成 沉淀而持续被除去。
沉淀而持续被除去。
(1)阳极的电极反应式是
(2)废水中的
 转化为
转化为 的离子方程式是
的离子方程式是(3)
 大于
大于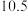 不利于
不利于 的生成,原因是
的生成,原因是
您最近一年使用:0次
【推荐3】丙烯是制造一次性医用口罩的重要原料。丙烷催化脱氢是工业生产丙烯的重要途径,丙烷催脱氢技术主要分为氧化脱氢和直接脱氢两种。回答下列问题:
(1)丙烷催化氧化脱氢法主要反应如下:
2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) △H1=-236kJ·mol-1(i)
2C3H6(g)+2H2O(g) △H1=-236kJ·mol-1(i)
反应过程中消耗的C3H8和 生成的C3H6的物质的量随温度的变化关系见下表。
①反应i中反应物的总能量_______ 生成物的总能量(填“大于”“小于”或“等于”)。
②分析表中数据得到丙烯的选择性随温度的升高而______ (填写“不变”“升高”“降 低”); 出现此结果的原因除生成乙烯等副产物外还可能是 _________ 。(C3H6的选择性=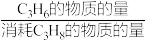 ×100%)
×100%)
(2)丙烷催化直接脱氢反应: C3H8(g) ⇌C3H6(g)+ H2(g) △H2=+124. 3kJ•mol -1 ( ii ) 副反应:C3H8 (g) ⇌C2H4 (g) + CH4(g) △H3(iii)
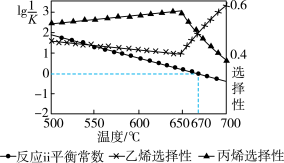
①反应 ii 的平衡常数、产物丙烯选择性、副产物乙烯选择性与温度关系如图所示, 分析工业生产中采用的温度为 650°C 左右的原因是_________ 。
②温度为 670°C 时,若在 1L 的容器中投入 8 molC3H8,充分反应后,平衡混合气体中有 2molCH4和一定量C3H8、C3H6、H2、C2H4,计算该条件下C3H6的选择性为___ %。
③欲使丙烯的产率提高,下列措施可行的是______ ( 填写序号 )
a.恒压条件下向原料气中掺杂水蒸气 b.增大氢气与丙烷的投料比 c.选择对脱氢反应更好选择性的催化剂 d.大压强
(3)科学家探索出利用无机膜催化丙烷脱氢制丙烯的新工艺,该工艺利用特定功能膜将生成的氢气从反应区一侧有选择性的及时移走,从平衡角度分析该工艺的优点______ 。
(1)丙烷催化氧化脱氢法主要反应如下:
2C3H8(g)+O2(g)
 2C3H6(g)+2H2O(g) △H1=-236kJ·mol-1(i)
2C3H6(g)+2H2O(g) △H1=-236kJ·mol-1(i)反应过程中消耗的C3H8和 生成的C3H6的物质的量随温度的变化关系见下表。
| 反应温度/℃ n(消耗)或n(生成)/mol | 535 | 550 | 575 |
| C3H8 | 6 | 13 | 33 |
| C3H6 | 4 | 8 | 17 |
①反应i中反应物的总能量
②分析表中数据得到丙烯的选择性随温度的升高而
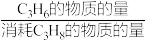 ×100%)
×100%)(2)丙烷催化直接脱氢反应: C3H8(g) ⇌C3H6(g)+ H2(g) △H2=+124. 3kJ•mol -1 ( ii ) 副反应:C3H8 (g) ⇌C2H4 (g) + CH4(g) △H3(iii)

①反应 ii 的平衡常数、产物丙烯选择性、副产物乙烯选择性与温度关系如图所示, 分析工业生产中采用的温度为 650°C 左右的原因是
②温度为 670°C 时,若在 1L 的容器中投入 8 molC3H8,充分反应后,平衡混合气体中有 2molCH4和一定量C3H8、C3H6、H2、C2H4,计算该条件下C3H6的选择性为
③欲使丙烯的产率提高,下列措施可行的是
a.恒压条件下向原料气中掺杂水蒸气 b.增大氢气与丙烷的投料比 c.选择对脱氢反应更好选择性的催化剂 d.大压强
(3)科学家探索出利用无机膜催化丙烷脱氢制丙烯的新工艺,该工艺利用特定功能膜将生成的氢气从反应区一侧有选择性的及时移走,从平衡角度分析该工艺的优点
您最近一年使用:0次



