水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为________________ ;
(2)H2O分子中氧原子采取的是_____ 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是_____ 。
(4)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:___________________________ 。
(1)水分子中氧原子在基态时核外电子排布式为
(2)H2O分子中氧原子采取的是
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.水合氢离子分子构型是三角锥型 | D.微粒中的键角发生了改变 |
12-13高二下·全国·阶段练习 查看更多[2]
更新时间:2016/12/09 07:58:12
|
【知识点】 分子结构与性质
相似题推荐
填空题
|
适中
(0.65)
【推荐1】下图是短式元素周期表的一部分。
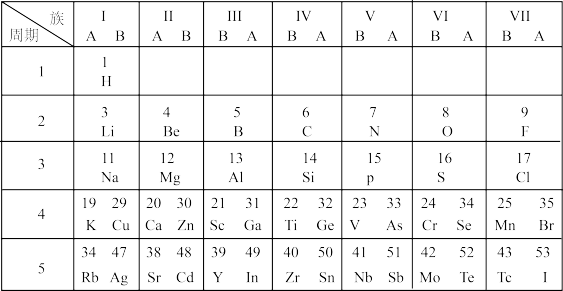
(1)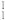 H和
H和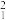 H互为
H互为___________ 。
(2)H2O的电子式为___________ ,GeH4分子的空间结构为___________ 。
(3)向NaBr溶液中滴加___________ (填试剂名称),若发生反应___________ (用离子方程式表示),则证明Cl原子得电子能力比Br原子强。
(4)在实验室用无水乙醇和冰醋酸制备乙酸乙酯的化学方程式为___________ 。
(5)前三周期元素X、Y原子序数依次增大,原子X、Y的最外层电子数均为K层的2倍。工业上利用单质X制备单质Y的化学方程式为___________ 。
(6)SF6分子的空间结构为正八面体形,如图所示。1 mol SF6中含有___________ mol S—F键,它的二氯代物SF4Cl2有___________ 种。
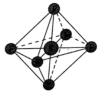

(1)
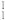 H和
H和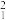 H互为
H互为(2)H2O的电子式为
(3)向NaBr溶液中滴加
(4)在实验室用无水乙醇和冰醋酸制备乙酸乙酯的化学方程式为
(5)前三周期元素X、Y原子序数依次增大,原子X、Y的最外层电子数均为K层的2倍。工业上利用单质X制备单质Y的化学方程式为
(6)SF6分子的空间结构为正八面体形,如图所示。1 mol SF6中含有

您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】B、C、N、Si是几种常见的重要非金属元素,其形成的各种化合物在自然界中广泛存在。
(1)基态硅原子的电子排布式为________________ ;C、N、O元素原子的第一电离能由大到小的顺序为________________ ;写出一种与CO32-互为等电子体的阴离子:_________ ;
(2)BF3 与一定量的水可形成如图所示晶体R
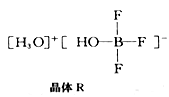
①晶体R中各种微粒间的作用力涉及___________ (填字母代号),
a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力
②晶体R 中阴离子的空间构型为________________________ ;
(3)乙二胺(H2NCH2CH2NH2)与CuCl2溶液可形成配离子(结构如图所示),乙二胺分子中氮原子的杂化类型为________________ ;

乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是__________ ;
(1)基态硅原子的电子排布式为
(2)BF3 与一定量的水可形成如图所示晶体R
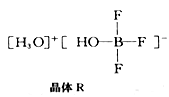
①晶体R中各种微粒间的作用力涉及
a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力
②晶体R 中阴离子的空间构型为
(3)乙二胺(H2NCH2CH2NH2)与CuCl2溶液可形成配离子(结构如图所示),乙二胺分子中氮原子的杂化类型为

乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】已知N、P同属于元素周期表的第ⅤA族元素,N在第二周期,P在第三周期。 分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是
分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是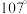 。
。
(1) 分子的空间结构为
分子的空间结构为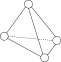 ,它是一种
,它是一种_____ (填“极性”或“非极性”)分子。
(2) 分子与
分子与 分子的构型关系
分子的构型关系_____ (填“相同”“相似”或“不相似”),P—H键_____ (填“有”或“无”)极性, 分子
分子_______ (填“有”或“无”)极性。
(3) 是一种淡黄色油状液体,下列对
是一种淡黄色油状液体,下列对 的有关描述不正确的是
的有关描述不正确的是___ (填字母)。
a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
d.因N—Cl键的键能大,故 稳定
稳定
 分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是
分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是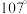 。
。(1)
 分子的空间结构为
分子的空间结构为 ,它是一种
,它是一种(2)
 分子与
分子与 分子的构型关系
分子的构型关系 分子
分子(3)
 是一种淡黄色油状液体,下列对
是一种淡黄色油状液体,下列对 的有关描述不正确的是
的有关描述不正确的是a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
d.因N—Cl键的键能大,故
 稳定
稳定
您最近半年使用:0次



