实验需要0.1mol/LNaOH溶液450ml,根据溶液配制中情况回答下列问题:
(1)实验中必须用到的玻璃仪器有:______ .
(2)根据计算得知,所需NaOH的质量为______ g.
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______ ;
A.用50mL水洗涤烧杯2﹣3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的NaOH的质量,倒入烧杯中加入适量水,用玻璃棒慢慢搅动.
C.将已冷却的NaOH溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.加水至离刻度线1~2cm处改用胶头滴管加水,使溶液凹面恰好与刻度相切
(4)下列操作对所配浓度有何影响(填写字母)
偏大的有______ ;偏小的有______ ;无影响的有______ 。
A.称量用了生锈的砝码; B.将NaOH放在纸张上称量;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D.往容量瓶转移时,有少量液体溅出 E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线 G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
(1)实验中必须用到的玻璃仪器有:
(2)根据计算得知,所需NaOH的质量为
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
A.用50mL水洗涤烧杯2﹣3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的NaOH的质量,倒入烧杯中加入适量水,用玻璃棒慢慢搅动.
C.将已冷却的NaOH溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.加水至离刻度线1~2cm处改用胶头滴管加水,使溶液凹面恰好与刻度相切
(4)下列操作对所配浓度有何影响(填写字母)
偏大的有
A.称量用了生锈的砝码; B.将NaOH放在纸张上称量;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D.往容量瓶转移时,有少量液体溅出 E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线 G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
更新时间:2016-12-09 09:54:01
|
【知识点】 化学计量
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】以高硫铝土矿(主要成分为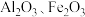 ,还含有少量
,还含有少量 )为原料,生产氧化铝并获得
)为原料,生产氧化铝并获得 的部分工艺流程如下:
的部分工艺流程如下:
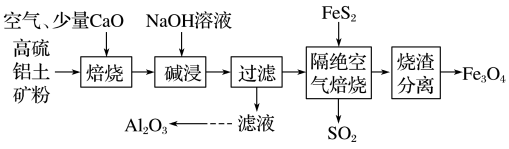
请回答下列问题:
(1)加入CaO的目的是_____ 。
(2)利用生成的氧化铝冶炼铝的反应为_____ 。
(3)分离烧渣中 最简单的方法为
最简单的方法为_____ 。
(4)隔绝空气焙烧时发生的反应为 ,则理论上生成2.24L(标准状况下)
,则理论上生成2.24L(标准状况下) 时,消耗
时,消耗 的质量为
的质量为_____ g。
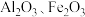 ,还含有少量
,还含有少量 )为原料,生产氧化铝并获得
)为原料,生产氧化铝并获得 的部分工艺流程如下:
的部分工艺流程如下:
请回答下列问题:
(1)加入CaO的目的是
(2)利用生成的氧化铝冶炼铝的反应为
(3)分离烧渣中
 最简单的方法为
最简单的方法为(4)隔绝空气焙烧时发生的反应为
 ,则理论上生成2.24L(标准状况下)
,则理论上生成2.24L(标准状况下) 时,消耗
时,消耗 的质量为
的质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】钛( )被誉为“第三金属”,广泛用于航天、国防领域。以金红石(主要成分是
)被誉为“第三金属”,广泛用于航天、国防领域。以金红石(主要成分是 )为原料制备高纯度钛的流程如图。回答下列问题:
)为原料制备高纯度钛的流程如图。回答下列问题:
已知:常温下,钛不与7%以下的盐酸、5%以下的硫酸反应,能与浓盐酸、浓硫酸反应。
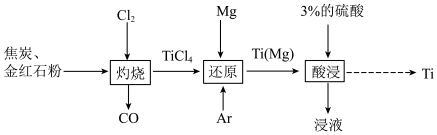
(1) 中
中 的化合价为
的化合价为_______ 。
(2)“灼烧”时生成 反应的化学方程式为
反应的化学方程式为_______ ,在该反应中氧化剂是_______ (填化学式),标准状况下生成11.2L氧化产物时转移电子的物质的量为_______ 。
(3)“还原”中通入氩气( )的作用是
)的作用是_______ 。由冶炼钛的原理可推知,钛在金属活动顺序表中的位置可能是_______ (填标号)。
A.铝之前 B.镁与铜之间 C.铜之后
(4)“酸浸”之后,过滤、洗涤、干燥后得到钛。检验钛是否洗净的操作是_______
(5)“浸液”经过蒸发浓缩、降温结晶、过滤,得到晶体 ,若
,若 的摩尔质量为
的摩尔质量为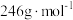 ,则
,则 的化学式为
的化学式为_______ 。
 )被誉为“第三金属”,广泛用于航天、国防领域。以金红石(主要成分是
)被誉为“第三金属”,广泛用于航天、国防领域。以金红石(主要成分是 )为原料制备高纯度钛的流程如图。回答下列问题:
)为原料制备高纯度钛的流程如图。回答下列问题:已知:常温下,钛不与7%以下的盐酸、5%以下的硫酸反应,能与浓盐酸、浓硫酸反应。

(1)
 中
中 的化合价为
的化合价为(2)“灼烧”时生成
 反应的化学方程式为
反应的化学方程式为(3)“还原”中通入氩气(
 )的作用是
)的作用是A.铝之前 B.镁与铜之间 C.铜之后
(4)“酸浸”之后,过滤、洗涤、干燥后得到钛。检验钛是否洗净的操作是
(5)“浸液”经过蒸发浓缩、降温结晶、过滤,得到晶体
 ,若
,若 的摩尔质量为
的摩尔质量为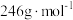 ,则
,则 的化学式为
的化学式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】我国力争在2060年前实现“碳中和”,综合利用CO2具有重要的意义。30 MPa、200°C条件下,CO2与H2反应可制得气态甲醇(CH3OH),其反应方程式为:CO2+3H2 CH3OH+H2O(g)
CH3OH+H2O(g)
(1)已知生成32 g CH3OH放出热量49 kJ,该反应的热化学方程式为_______ 。
(2)在该反应中,表示该反应速率最快的是:_______
(3)在实际生产中,测得合成塔中H2及H2O(g)的物质的量随时间变化如图所示,则图中代表H2的曲线是_______ (填“X”或“Y”)。

(4)在一定温度下,将2 mol CO2与6 mol H2气体混合于2 L密闭容器中制甲醇,2 min末生成0.8 mol H2O(g),则:
①用单位时间内CO2浓度的减小来表示2 min内该反应的平均速率为_______ ;
②2 min末容器中H2的物质的量浓度为_______
 CH3OH+H2O(g)
CH3OH+H2O(g)(1)已知生成32 g CH3OH放出热量49 kJ,该反应的热化学方程式为
(2)在该反应中,表示该反应速率最快的是:_______
| A.v(CO2)=30 mol·L-1·min-1 | B.v(CH3OH)=0.3 mol·L-1·s-1 |
| C.v(H2)=0.8 mol·L-1·s-1 | D.v(H2O)=0.6 mol·L-1·s-1 |

(4)在一定温度下,将2 mol CO2与6 mol H2气体混合于2 L密闭容器中制甲醇,2 min末生成0.8 mol H2O(g),则:
①用单位时间内CO2浓度的减小来表示2 min内该反应的平均速率为
②2 min末容器中H2的物质的量浓度为
您最近一年使用:0次



