将8.1g铝与足量的氢氧化钠溶液反应,计算:
(1)生成的气体在标准状况下的体积;(2)需要氢氧化钠的物质的量。
(1)生成的气体在标准状况下的体积;(2)需要氢氧化钠的物质的量。
更新时间:2016-01-13 11:21:37
|
【知识点】 化学方程式计算中物质的量的运用解读
相似题推荐
计算题
|
适中
(0.65)
【推荐1】向100 ml水中投入Na和Al共15 g,充分反应后,剩余金属为5 g
(1)计算放出H2多少升(标准状况下)______________
(2)过滤出未反应的金属,向滤液中逐滴加入4 mol/L的HCl溶液,生成沉淀的最大值是多少_____________ ?此时消耗HCl溶液的体积是多少?______________
(1)计算放出H2多少升(标准状况下)
(2)过滤出未反应的金属,向滤液中逐滴加入4 mol/L的HCl溶液,生成沉淀的最大值是多少
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】称取Na2CO3和NaOH固体混合物5.32 g,溶于水后加入60 mL 1.0 mol/L的Ba(OH)2溶液充分反应,经过滤、洗涤、干燥,称得沉淀3.94 g。为将滤液处理至中性后达标排放,需加入50 mL稀硫酸。请计算:
(1)混合物中NaOH的质量________________ 。
(2)稀硫酸物质的量浓度__________________ 。
(1)混合物中NaOH的质量
(2)稀硫酸物质的量浓度
您最近一年使用:0次

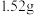 铜镁合金完全溶解于50mL8mol/L的浓硝酸中,得到NO和NO2的混合气体896mL(标准状况),向反应后的溶液中加入
铜镁合金完全溶解于50mL8mol/L的浓硝酸中,得到NO和NO2的混合气体896mL(标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
溶液,当金属离子全部沉淀时,得到2.54g沉淀。求: 。
。

